〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。

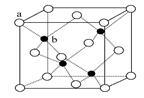
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。

已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是____(填元素符号),D元素的原子核外有 种不同运动状态的电子;有 种不同能级的电子。基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是 。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的

(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:该配离子中含有的化学键类型有 。(填字母)

a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2一NH2)中C原子的杂化方式为 。
[化学—选修3:物质结构与性质]早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: ,可用硫氰化钾检验三价铁离子,形成配合物的颜色为 。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ,一摩尔乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm(晶胞参数就是晶胞立方体的边长),晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
(15分) A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 ="578" kJ/mol,I2="1" 817 kJ/mol,I3=" 2" 745 kJ/mol,I4 ="11" 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。

[化学—选修3:物质结构与性质]已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子,B的基态原子中有6种不同运动状态的电子,C原子核外成对电子数比未成对电子数多1,其氢化物常用作制冷剂,D原子中有2个未成对电子,E基态原子在同周期中原子半径最大,F原子价电子排布为nsn-1nPn+1 ,G基态原子核外所有轨道都处于全满状态且属ds区的元素。
(1)G基态原子价电子排布式 ;
(2)B、C、D基态原子第一电离能由大到小的顺序 ;
(3)离子化合物CA5的晶体中含有的化学键有 ;
A.离子键
B.极性键
C.非极性键
D.配位键
E.金属键
(4)E2D的熔点比E2F的熔点 (填“高”或“低”),原因是 ;
(5)与BD2互为等电子体的分子有 (要求写一种)
(6)GF在荧光体、光导体材料、涂料、颜料等行业中应用广泛。GF晶体结构如图所示,其晶胞边长为x pm,该晶体的密度为 g·cm-3(列式表示),a、b位置两粒子之间的距离为 pm(列式表示)(已知阿伏伽德罗常数为NA)
有A、B、C、D、E五种原子序数均小于30且依次增大的元素。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)C、D形成的化合物化学式为______,A的单质分子中π键的个数为________。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是_____________。
(3)A、B、C三种元素的第一电离能由大到小的顺序为______(用元素符号表示)。
(4)向E单质与适量浓硫酸反应后的溶液中逐滴加入A的最简单气态氢化物的水溶液,看到的现象是____________。
(5)A的最简单氢化物分子易与H+结合生成空间正四面体形的阳离子,而A与C形成的分子却难与H+结合,原因是_____________。
(6)C和D形成的化合物的晶胞结构如上图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=________cm(用ρ、NA的计算式表示) 。
[选修3—物质结构与性质]钒是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个 键。
键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
【化学------选修物质结构与性质】五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 ;(填元素符号)(各1分);
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是 ;(用化学式表示);
(3)甲和乙形成的化合物的中心原子的杂化类型为 ;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为 ;(各2分)
(4)除乙外,上述元素的电负性从大到小依次为 ;(填元素符号);
(5)单质戊与水反应的离子方程式为 ;
(6)一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应,则产物为 ,(用化学式表示)其物质的量之比为 (各2分)。
已知A、B、C、D、E、F、G七种元素原子序数均小于36,它们的核电荷数依次增大。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的基态电子排布中L能层有两个未成对电子,E和D同主族;F原子的基态电子排布中有4个未成对电子;G与F在周期表中同族,且G原子的外围电子排布中有2个未成对电子。根据以上信息填空:
(1) B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)
(2)F2+离子的价层电子排布图是 ,
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,E元素的氢化物的VSEPR模型为 。
(4)A和C形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物_____(填化学式);其中心原子C的杂化方式为 。
(5)化合物BD2、C2D和阴离子EBC-互为等电子体,它们结构相似,EBC-的电子式为 。F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为_______;
(6)GD的晶体结构与氯化钠相同,在晶胞中G离子的配位数是_______;已知晶胞的边长为a nm,晶体的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则晶体的密度为_________g·cm-3。
发展低成本、新型太阳能是解决未来社会能源问题的有效途径。目前,太阳能电池的发展已经进入了第三代,其常用材料除单晶硅,还有铜铟镓硒等化物质。完成下列填空:
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式_________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示) 。
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是___________;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B—X键都当作单键考虑来计算键长,理论值与实测键长结果如下表。硼卤键长实测值比计算值要短得多,可能的原因是______________。

(4)金属铜能形成多种配合物,如复合物氯化羰基亚铜[Cu2C12(CO)2·2H2O],其结构如图。

①该配合物中Cl原子的杂化类型为____________。
②该配合物中的配位体有_____________种。
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(6)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子,则得如图所示的金刚砂(SiC)结构。在SiC中,每个C原子周围最近的C原子数目为_____;若SiC晶体密度为a g.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为 pm (列式表示)。

(1、2、3班必做)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(用元素符号表示)。
(3)B2A4是石油炼制的重要产物之一。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。
(4-5必做)根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为__________。某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(2)根据VSEPR模型,PO43-的分子立体结构为: ;乙醇易溶于水的原因是 ;HClO4的酸性强于HClO的原因是 ;
(3)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是_____。写出铬元素在周期表中的位置________,它位于______区。
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为 g/cm3。
(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,与N3-互为等电子体的分子的化学式 (写1种)NH2-的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2-中的键型为 ,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为 。
(5)治癌药物B的结构简式为 。
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。元素Y基态原子的3p轨道上有5个电子。元素Z的原子最外层电子数是其内层的3倍。元素W基态原子核外电子共有16种运动状态。
(1)①在元素周期表中,元素Y位于第 周期第 族,元素X位于 区;
②Z所在周期中,第一电离能最大的元素是 (填元素名称);
③X+的核外电子排布式为 ;
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是 (填化学式)。
(2)X与Y所形成化合物晶体的晶胞如图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(3)X与W的最高价含氧酸的浓溶液反应的化学方程式为 。
[化学——选修3: 物质结构与性质]Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。
(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度为 。
试题篮
()