黑火药是中国四大发明之一,其爆炸的化学反应方程式是:
2KNO3 + 3C + S→ + N2↑ + 3CO2↑
+ N2↑ + 3CO2↑
(1)方程式中第二周期元素中非金属性由强到弱的顺序依次为 。
(2)上述元素中,元素原子最外层有2个未成对电子的是 。
(3)在生成物中:A物质的晶体类型为 ;构成晶体A的微粒半径大小关系为 (用微粒符号表示);含极性共价键的非极性分子为 。
(4)已知CN—与N2结构相似,写出HCN分子的结构式 。
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。
【化学—选修3:物质结构与性质】
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。
则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
[化学——选修3:物质结构与性质]已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,
化合物的化学式,甲为________,乙为____________;高温时,甲易转化为乙的原因为____________。
固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于__________晶体,它的电子式为__________。
(2)A溶于水后溶液呈__________性(填“酸”“碱”或“中”),其原因是(用化学方程式表示)______________________________。
(3)A与铜或铜的某些化合物在一定条件下可合成CuH,CuH是一种难溶物,它能在氯气中着火,还能与盐酸反应放出气体,请写出这两种反应的化学方程式___________________ 。
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
| A.分子中N、O间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 |
| D.15.2g该物质含有6.02×1022个原子 |
前四周期原子序数依次增大的元素A,B,C,D中, A是电负性最大的元素,并且A-和B+的电子数相差为8;C和D原子序数相差为2,且都与B位于同一周期,C元素的次外层电子数是最外层电子数的7倍。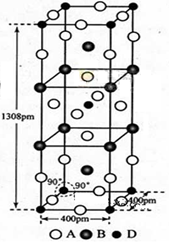
回答下列问题:
(1)D的价层电子排布式为_______。
(2)请用电子式表示A、B两元素形成化合物的过程。 。
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度___ ____g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_ ____;该化合物中存在一个复杂离子,该离子的化学式为___ ____,配位数是_ __。
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为 ,Y的简单氢化物分子式为 。
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为________。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。
①甲的化学式为______________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离U+ 最近的Z2- 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是________________cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
【化学一物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素n的基态原子的价电子排布式 ,元素O在周期表的位置是 ,属于 区。
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化方式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如左下图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如右下图乙所示。则晶胞中i原子的配位数为 。
喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( )
气体 |
溶液 |
|
A. |
H2S |
稀盐酸 |
B. |
HCl |
稀氨水 |
C. |
NO |
稀H2SO4 |
D. |
CO2 |
饱和NaHCO3溶液 |

A.AB.BC.CD.D
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是
| A.由二氧化碳合成金刚石是化学变化 | B.金刚石是碳的一种同位素 |
| C.钠被氧化最终生成碳酸钠 | D.金刚石中只含有非极性共价键 |
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)请写出元素d的基态原子电子排布式________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是_______。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为M,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。

则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为 ;
(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如右图所示。X的元素符号是______,X离子与N3-形成的化合物化学式为______。
(3)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
A B C D E
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
试题篮
()