在一定条件下,Na2CO3溶液中存在水解平衡:CO32﹣+H2O⇌HCO3﹣+OH﹣.下列说法不正确的是
| A.通入CO2,溶液pH减小 |
| B.加入少量NH4Cl固体,平衡向正反应方向移动 |
C.慢慢升高温度, 逐渐减小 逐渐减小 |
| D.加入NaOH 固体后冷却到室温,溶液的KW=c(OH﹣)•c(H+)不变 |
H2与O2发生反应的过程用模型如下(“﹣”表示化学键):下列说法不正确的是
| A.过程Ⅰ是吸热过程 |
| B.过程Ⅲ一定是放热过程 |
| C.该反应过程所有旧化学键都断裂,且形成了新化学键 |
| D.该反应的能量转化形式只能以热能的形式进行 |
浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 |
下列有关电化学装置的说法正确的是
| A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2- |
| B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
在25℃时将pH=11的NaOH溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是
| A.c (Na+)=c(CH3COO-)+c(CH3COOH) |
| B.c(H+)=c(CH3COO-)+c(OH-) |
| C.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) |
下列关于化学反应的自发性叙述中正确的是
| A.△H>0、∆S>0的反应肯定是自发的 |
| B.△H>0、∆S<0的反应肯定是自发的 |
| C.△H<0、∆S>0的反应肯定是自发的 |
| D.△H<0、∆S<0的反应高温时是自发的 |
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是
| A.5ν(NH3)=4ν(O2) | B.5ν(O2)=6ν(H2O) |
| C.2ν(NH3)=3ν(H2O) | D.5ν(O2)=4ν(NO) |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是

| A.4-3-1-2 | B.3-4-2-1 | C.1-2-3-4 | D.1-2-4-3 |
向含有a molFeBr2的溶液中通入x molCl2。下列各项通入Cl2,溶液内发生反应的离子方程式,其中不正确的是
| A.当x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.当x=0.6a,2Br-+Cl2=Br2+2Cl- |
| C.当x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.当x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
如图是产生和收集气体的实验装置,该装置最适合于( )
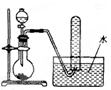
| A.用浓硝酸和Cu反应制取NO2 |
| B.用浓盐酸和MnO2反应制取Cl2 |
| C.用NH4Cl和Ca(OH)2反应制取NH3 |
| D.用H2O2溶液和MnO2反应制取O2 |
下列转化中,均不能通过一步反应实现的是
| A.Na2O2→Na2CO3→NaOH | B.SiO2→Si→Na2SiO3 |
| C.NH3→NO2→HNO3 | D.S→SO2→NaHSO3 |
日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
| A.古铜币上出现铜绿[Cu2(OH)2CO3] | B.铝制用品表面变暗 |
| C.钢铁生锈 | D.氢氧化钠固体潮解 |
同温同压下,加热NaHCO3至完全分解,放出的CO2用Na2O2来吸收,则NaHCO3与Na2O2的最佳物质的量之比为( )
| A. 1:1 | B.1:2 | C.2:1 | D.2:3 |
一定量的MnO2与xmL10mol/L的盐酸共热制取氯气,在标准状况下产生2.24L。则x的值应为( )
| A.x=20 | B.x=40 | C.20<x<40 | D.x>40 |
试题篮
()