把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
将Fe2O3溶于150mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36L(标准状况),溶液中不再有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
(1)Fe2O3的质量为 g ;
(2)稀H2SO4物质的量浓度为 。
标准状况下CO与CO2混合气体的平均相对分子质量为32。将该气体完全通入盛有足量Na2O2的容积为2.24升的密闭容器中(忽略固体物质的体积),引燃,完全反应后,容器内固体生成物的质量为__________g。
某银币(铜、银合金)质量为25g,为测定其元素的质量分数,向其中加入75 mL 12 mol·L-1的浓硝酸使其完全溶解。实验结束后,A中烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75 mL。
①计算参加反应的硝酸的物质的量是_______ mol。
②写出你设计的测定该银币中银的质量分数的最简单的实验方案(操作步骤及计算式)__________
在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。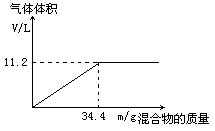
(1)试计算NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
试求:(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率
硫酸是化学工业中的重要原料,至2010年我国已成为全球硫酸产能最高、产量最大的国家。
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气。当浓硫酸浓度降到16 mol/L(密度1.8g/cm3)以下时,则失去干燥能力。
①16 mol/L的硫酸的质量分数为 (保留两位小数,下同)。
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水 g。
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 9.920 g,与足量稀硫酸反应,收集到气体2.688 L(换算到标准状况),质量为3.440 g。则固体M的成分为
(写化学式),其中铁元素与硫元素的质量比为 。
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20)。
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为 。
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为 %。
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐。为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下:
铵盐质量为10.000 g和20.000 g时,浓硫酸增加的质量相同;
铵盐质量为30.000 g时,浓硫酸质量增重0.680 g;
铵盐质量为40.000 g时,浓硫酸的质量不变。
①计算该混合盐中氮元素的质量分数。
②计算上述氢氧化钠溶液的物质的量浓度。
在标准状况下,将224L的HCl气体溶于635mL的水中(设水的密度为1.00g/cm3),求所得盐酸的质量分数。若取出这种盐酸(密度为1.19g/cm3)10.0mL稀释至1190mL,则稀释后盐酸的物质的量浓度为多少?
把5.1g镁铝合金的粉末放入500mL1mol·L-1盐酸中,恰好完全反应。试计算:
(1)该合金中镁和铝的物质的量各为多少mol。
(2)将等质量的该合金投入到足量的氢氧化钠溶液中,求标况下放出气体的体积。
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl中的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积。
将某种碳酸钠晶体(Na2CO3 · nH2O)和碳酸氢钠的混合物11.24 g,加热到质量不再减少,剩余残渣8.48 g。加热时产生的气体依次通过浓H2SO4和NaOH溶液后,NaOH溶液增重1.32 g(假设气体全部被吸收)。试计算:
(1)求n的值
(2)求混合物中碳酸钠晶体与碳酸氢钠的物质的量。
将11.26克小苏打和纯碱晶体(Na2CO3• 10H2O)的混合物加热充分反应后,残留固体溶于水,配制成100克溶液,所得溶液中Na2 CO3的质量分数为6.36%,试求:
CO3的质量分数为6.36%,试求:
(1)原混合物中含小苏打及纯碱晶体的质量各是多少?
(2)若加热原混合物将失重多少克?
(5分)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
1)6.50g锌的物质的量;
2)所用盐酸 的物质的量浓度;
的物质的量浓度;
3)反应中生成的H2在标准状况下的体积。
试题篮
()