在100mL稀硫酸和稀盐酸的混合溶液中加入3.42g氢氧化钡固体,充分反应后(若溶液体积不变),过滤、干燥得沉淀2.33g,经测定滤液pH=13。试求原混合溶液中硫酸和盐酸的物质的量浓度分别是多少?
实验室可用如下反应制取氯气,反应原理如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比
(3)15.8g KMnO4能使多少克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为多少?(
某银币(铜、银合金)质量为25g,为测定其元素的质量分数,向其中加入75 mL 12 mol·L-1的浓硝酸使其完全溶解。实验结束后,A中烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75 mL。
①计算参加反应的硝酸的物质的量是_______ mol。
②写出你设计的测定该银币中银的质量分数的最简单的实验方案(操作步骤及计算式)__________
将标准状况下的HCl气体4.48 L溶于水形成100 mL溶液,然后与足量的铁屑充分反应。计算:(1)所得盐酸溶液的物质的量浓度。
(2)参加反应的铁的质量。
(3)生成的H2的体积(标况)。
(4)将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度是多少?
在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 |
甲 |
乙 |
丙 |
| 合金质量 |
0.390g |
0.702g |
0.936g |
| 气体体积 |
448mL |
672mL |
672mL |
分析上表数据后计算:
(1)盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0. 2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,求:
(1)该烃的相对分子质量 (2)确定该烃的分子式
(3)如果该烃的一氯取代物有4种,写出该烃的结构简式
(4)烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是(任写一种可能的结构简式)
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
试求:(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率
某样品含亚硫酸钠和少量的硫酸钠。现取一定量样品溶于100mL水配成溶液,再加足量的氯化钡溶液,过滤、洗涤、干燥,得沉淀13.18g。若将这些固体中加入足量的稀盐酸,充分反应后,再过滤、洗涤、干燥,得固体不溶物为2.33g。则:(1)样品中亚硫酸钠的物质的量为多少? (2)样品中硫酸酸钠的质量分数为多少?
稀硝酸和铜反应的化学方程式如下:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,如果有3.2克铜和硝酸恰好完全反应,试计算:
(1)在标准状况下产生气体的体积是________L。
(2)将所得溶液加水配成200mL溶液,则溶液的物质的量浓度是________(保留2位有效数字)。
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和 Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
(7分)某仅由C、H、O三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在O2中完全燃烧,将产物先后通过浓H2SO4和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
我们可以通过以下实验步骤来验证醋酸银(CH3COOAg)的溶度积KSP=2.0×10-3:将已知质量的铜片加入到CH3COOAg饱和溶液中(此饱和溶液中没有CH3COOAg固体),待充分反应之后,将铜片冲洗 干净、干燥、称重.
干净、干燥、称重.
(1)写出表示CH3COOAg沉淀溶解平衡的方程式.
(2)刚开始铜片的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,通过 计算说明当充分反应
计算说明当充分反应 后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(
后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(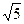 =2.24,
=2.24,  =1.41)
=1.41)
试题篮
()