在557℃时,密闭容器中进行下列反应CO+H2O CO2+H2。若(1)(2),达到平衡时,测得CO2的浓度为1.2mol/L。求CO及H2O的转化率。
CO2+H2。若(1)(2),达到平衡时,测得CO2的浓度为1.2mol/L。求CO及H2O的转化率。
合成氨反应N2(g)+3H2(g)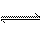 2NH3(g)在某温度下达平衡时,各物质的浓度是c(N2)="3" mol ·L-1,c(H2)="9" mol ·L-1,c(NH3)="4" mol ·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是c(N2)="3" mol ·L-1,c(H2)="9" mol ·L-1,c(NH3)="4" mol ·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
海水中溴常以NaBr形式存在,经分析海水中含溴0.07%,则海水中含NaBr的质量分数为_________________。从海水中提取溴的方法之一是:
①通入Cl2至浓缩的溴化物溶液,然后用空气把生成的溴吹出。
②Na2CO3溶液吸收溴(其中有 的溴的物质的量转化为Br-),同时放出CO2。
的溴的物质的量转化为Br-),同时放出CO2。
③向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。
④得到的溴中可能夹杂少量的Cl2,再加入FeBr2除去。
第一步反应的离子方程式______________________________________________。
第二步反应的化学方程式______________________________________________。
第三步反应中氧化剂的化学式是________________________________________。
向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。
(1)W的可能组成为①____________;②________;③____________;④____________。(填化学式,可以多填或少填)
(2)现将NaBr与NaI的混合固体10.0 g溶于适量水中,通入448 mL Cl2(标准状况)充分反应后,按上述操作得到W的质量为7.28 g。求原混合物中NaI的质量分数。
少量的碘化物可用以下方法进行测定,其步骤如下:
①在中性或弱酸性介质中先用过量的Br2,将试样中的I-氧化成 ;
;
②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将 还原为I2;
还原为I2;
③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2====2NaI+Na2S4O6)。
通过上述步骤可测得碘化物中I-的含量:
(1)写出步骤①②中发生反应的离子方程式:
①__________________________________________,
②__________________________________________。
(2)若样品中有1 mol I-,则最后耗用Na2S2O3的物质的量是多少?
(3)若在测定时,准确量取含KI的样品溶液25.00 mL,终点时耗用0.050 mol·L-1 Na2S2O3溶液20.06 mL,试计算样品溶液中KI的含量(g·L-1)。
完全中和10.2 g某二元酸H2A时,消耗了24 g NaOH。
试求:
(1)10.2 g该二元酸的物质的量是多少?
(2)该二元酸的摩尔质量是多少?A的相对原子质量是多少?
(3)已知A的原子核中质子数与中子数相等,则A为何种元素?
下图是医院病人输液时用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签上的所列内容后填写
| 葡萄糖注射液 Glucose Injection 规格:250 mL内含葡萄糖12.5 g 生产批号:0203203 2 有效期:至2004年3月 配伍:5% 姓名: 床号: |
(1)该溶液中含__________________g。
(2)该溶液的密度约为_________________g·mL-1。
(3)该溶液的物质的量浓度__________________。
在500 mL CuSO4和Fe2(SO4)3的混合溶液中加入21.7 g铁粉,待反应完全后,得到16.8 g残留固体。在滤液中加入400 mL 4 mol·L-1的BaCl2溶液,恰好使溶液中的 完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
在标准状况下,将224 L HCl气体溶于645 mL (ρ=1.00 g·cm-3)的水中,所得盐酸的密度为1.20 g·cm-3。试求:
(1)该盐酸的物质的量浓度。
(2)标准状况下,取这种盐酸100 mL,与足量的NaHCO3溶液反应后,放出多少升气体?气体干燥后,通过盛有足量Na2O2固体的容器,充分反应后,容器内固体增重多少克?
标准状况下,a L Cl2通入到1 Lb mol/L的FeI2溶液中,充分反应后,所得溶液中Fe2+的物质的量浓度与a、b的关系如下表,请完成其余空格。
| a、b的关系 |
Fe2+的物质的量浓度(mol/L) |
| a≤22.4b |
①___ |
| ②_____ |
0 |
| 22.4b≤a≤33.6b |
③____ |
已知KHCO3在t1℃时的溶解度为50g,向该温度下的KHCO3饱和溶液300 g中加入148g一定浓度的硝酸溶液,恰好完全反应。求:
(1)反应前该饱和溶液中含KHCO3的物质的量是多少?
(2)完全反应后所得KNO3溶液的质量分数是多少?
(3)将反应后的KNO3溶液冷却,当温度下降到t2℃时,溶液浓度为20%,此时共析出无水晶体多少g?
将70 g Na2O2和Na2O的混合物跟98 g水充分反应后,所得氢氧化钠溶液的质量分数为50%。试通过计算推断原混合物中过氧化钠和氧化钠的质量各是多少。
为了测定某铜银合金成分,将30g合金完全溶于80ml13.5mol/L的浓硝酸中,待反应完全后,收集到6.72L气体(标况),并测得溶液中H+浓度是1mol/L.假设反应后溶液体积仍为80ml,求合金中银的质量分数.
试题篮
()