锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
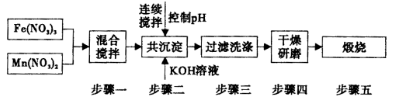
已知Fe3+、Mn2+沉淀的pH如表所示。
| |
开始沉淀 |
完全沉淀 |
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
有以下物质:①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: ,检验离子沉淀完全的方法是 ,洗涤沉淀的方法是 。
根据下面的反应路线及所给信息填空。

(1)① 的反应条件是: 。② 的反应类型是: 。(苯佐卡因)
(2)反应②的化学方程式: 。
(3)苯佐卡因有多种同分异构体,其中—NH2直接连在苯环上,分子结构中含有-COOR
官能团,且苯环上的一氯取代物只有两种的同分异构体共有六种,除苯佐卡因外,其中两种的结构简式是:
则剩余三种同分异构体的结构简式为: 、 、 。
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
| |
Fe(OH)3 |
Zn(OH)2 |
| 开始沉淀时 |
1.5 |
8.0 |
| 完全沉淀时 |
2.8 |
11.1 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。
(2)在操作①中保持pH=8的目的是____________________________。
(3)沉淀Ⅰ的主要成分是_______________________________________。
(4)操作③中调节pH的范围是___________________;目的是________________。
(1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:________________________。已知18 g液态水转化成水蒸气需吸热44 kJ,则反应2H2(g)+O2(g)===2H2O(l)的ΔH=________kJ·mol-1,氢气的标准燃烧热ΔH=__________kJ·mol-1。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)  2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是 (填字母)。
a.氮的氧化物 b.硫的氧化物 c.可吸入颗粒物 d.氟氯代烃 e.二氧化碳
②水是一种宝贵的自然资源。下列物质可用于水体消毒的是 ___(填字母)。
a.明矾 b.氯化铁 c.漂白粉
③垃圾焚烧是产生 __的主要途径之一(填字母)。
a.二噁英 b.SO2 c.NH3
(2)材料是人类赖以生存和发展的重要基础物质。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生 腐蚀,其正极的电极反应式是 。
②随着科学技术的发展,科学家研制了氮化硅等许多耐高温的物质,它们属于 ___(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③在尼龙、棉花、涤纶这三种物质中,属于天然纤维的是 __ 。
(3)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①有些药片常用淀粉作为黏合剂,淀粉进入人体后在人体内酶的催化作用下逐步水解,写出淀粉水解的方程式___________________,检验淀粉水解产物的试剂是______________。
②糖类、油脂、蛋白质都能为人体提供能量,等质量的糖类、油脂、蛋白质为人体提供能量最多的是________________。
③“服用维生素C,可使食物中的Fe3+变为Fe2+”这句话指出,维生素C在这一反应中作_________剂。
④阿司匹林( )与氢氧化钠反应可制得可溶性阿司匹林,疗效更好。写出阿司匹林与氢氧化钠的反应方程式_______________________________。
)与氢氧化钠反应可制得可溶性阿司匹林,疗效更好。写出阿司匹林与氢氧化钠的反应方程式_______________________________。
(4)合理饮食和正确使用药物,是人体健康的重要保证。
①1838年,林则徐在广东虎门销毁大量的鸦片,打击了当时烟贩的嚣张气焰。下列药物中属于毒品的是 。
A.砒霜 B.阿司匹林 C.甲基苯丙胺(冰毒)
②均衡的膳食结构可以保障身体健康,但并不是所有的食物均可以被人体吸收利用。下列营养物质不能被人体吸收利用的是 。
A.蛋白质 B.纤维素 C.无机盐
③微量元素在人体内含量极少,其质量不到体重的万分之一,但它们对维持生命活动、促进健康和生长发育有重要的作用。碘被称之为“智力元素”,下列物质 是目前在碘盐中添加的含碘化合物。
A.碘酸钾 B.碘单质 C. 碘化钾
(5)合理使用材料,改善人类生活。
①橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为 结构(填“线型”或“体型”),从而增大橡胶的强度;向其中加入 可以增大轮胎的耐磨性。
②玻璃制品在日常生活中的使用量很大,普通玻璃的原料有石英、 、石灰石,通常的玻璃呈浅绿色,是因为含有 (填离子)。彩色玻璃中是因为添加某些金属氧化物,红色玻璃是因为添加 (填化学式)。
③氧气和四氯化硅蒸气在旋转的高温炉中发生罝换反应,其产物之一可制得光导纤维,试写出该反应的化学方程式 。
溴、碘及其化合物在工农业生产和日常生活中有重要用途。
Ⅰ.氢溴酸在医药和石化工业上有广泛用途,下图是模拟工业制备氢溴酸的流程:

根据上述流程回答下列问题:
(1)反应①中发生反应的离子方程式为 ;使用冰水的目的是
(2)操作Ⅰ的名称是 ;操作Ⅱ的名称是 ;
(3)反应②中加入Na2SO3的目的是 ;但要防止过量,原因是 (用离子方程式表示)
Ⅱ.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物。XX′型卤素互化物与卤素单质结构相似、性质相近, 能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等。试回答下列问题:
(4)溴化碘(IBr)与水反应的方程式为IBr +H2O=HBr+HIO下列关于IBr的叙述中不正确的是
A.IBr中溴和碘的化合价均为0价 B.在许多反应中IBr是强氧化剂
C.在IBr与水的反应中,它既是氧化剂又是还原剂 D.与NaOH溶液反应生成NaIO、NaBr和H2O
(5) 在粗碘中含有IBr和ICl,受热时,I2、ICl、IBr均可升华。在粗碘中加入一种物质后,再进行升华,可制得精碘,应加入的物质是
A.H2O B.KI C.Zn D.KCl
现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④淀粉溶液 ⑤氨基酸。请回答:
(1)遇碘水呈蓝色的是 (填序号,下同)。
(2)能发生成肽反应的是 。
(3)能跟溴发生加成反应的是 。
(4)能跟银氨溶液发生银镜反应的是 。
(5)能跟饱和溴水反应生成白色沉淀的是 。
试题篮
()