A.《化学与生活》
(1)材料是人类赖以生存和发展的重要物质基础。
① 生产水泥的主要原料是黏土和 (填名称)。
② 橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施可增大强度和弹性,硫化后的
橡胶是 型结构。(选填“线型”或“体型”)。
③ 玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于 材料(选填“合金”或“复合”)。
④ 下列关于铁制品保护措施的说法中不正确的有 (填序号)。
A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
B.相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
C.在海轮的外壳上常焊有锌块,不必定期更新
D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
(2)人体健康与食品、药物等关系密切。
① 有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于
摄取 (选填“脂肪”、“维生素”或“蛋白质”)不足引起的。
② 生活中应合理地摄取人体必需的元素,体内 元素含量过低,会引起甲状腺疾病。
③ 糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下水解为 (写名称)。
④ 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为 。
⑤ 可以帮助流感病人解热镇痛的药物是 (选填“青霉素”或“阿司匹林”)。
(3)洁净安全的生存环境更是健康的保障。
① 绿色上海世博,亮点之一是二氧化碳零排放。为了适应低碳生活,参观世博园最好
是 (A.驾私家车 B.乘公交车)。
② 获得洁净安全的饮用水是每个人的正常需要。某农村地区洪涝灾害后为获得饮用水,
在将地表水取回家后,先加 (A.明矾 B.纯碱)再过滤,去除悬浮在水中的较大颗粒;过滤后常使用漂白粉进行杀菌消毒,其原理可用化学方程式表示为 。
B.《有机化学基础》
(1)有机物A的结构简式为: 。请回答:
。请回答:
①A的分子式为 。
②A中官能团的名称为 。
③A可发生的化学反应是 (填序号)。
A.消去反应 B.与溴水的取代反应 C.酯化反应
④1 mol A与氢氧化钠反应,消耗氢氧化钠物质的量是 mol。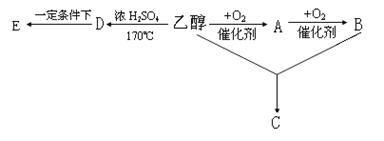
(2)由乙醇和其它无机原料合成C和一氯代物E的示意图如下:
请回答下列问题:
② 写出结构简式:乙醇 ,D 。
② 反应类型:乙醇→D: ,A→B:
(12分)反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为 ;
(3) B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第II阶段反应温度(T1)和第III阶段反应速度(T3)的高低:T2 T3
填“>、=、<”判断的理由是 ;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程为 。
(5)原电池反应①中正极的电极反应为 。
(7分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。选用前者而发生的离子方程式为 。但这一方程式所表示的制取原理与一般的情况有所不同,如强制弱、稳定制不稳定、难挥发制易挥发等,请用离子方程式表述将稀盐酸逐滴滴加到NaOH和Na2CO3混合溶液中的变化过程: 。
(6分)利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机
物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物
分子中氢原子的种类和数目。例如乙醚的结构简式为:CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值 (信号)有两个,如下图所示: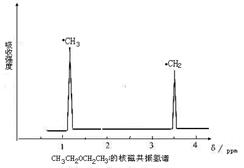
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3OCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为: _____ ,请预测B的核磁共振氢谱上有 个峰(信号)
_____ ,请预测B的核磁共振氢谱上有 个峰(信号)
(7分)已知尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_________________,其中苯环只与-OH和-COOR两类取代基直接相连的同分异构体有 种,写出其对位上所有同分异构体的结构简式___________ ___
(9分)乙炔(HC≡CH)是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成
以下化合物。完成下列各题:
(1)正四面体烷的分子式为 ,其二氯取代产物
有 种
(2)关于乙烯基乙炔分子的说法错误的是
| A.能使酸性KMnO4溶液褪色 |
| B.1mol乙烯基乙炔能与3molBr2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的结构简式
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
、
(1)键线式 表示的分子式 ;名称是 。
表示的分子式 ;名称是 。
(2)  中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)写出2,6—二甲基—4—乙基辛烷的结构简式:
(4)“ ”的名称为_____________________________________
”的名称为_____________________________________
(9分)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种异构体。A的结构
简式如下:
(提示:环丁烷“ ”可简写成“
”可简写成“ ”)
”)
(1)A的分子式是
(2)A与Br2的CCl4溶液反应的化学方程式(有机物用结构简式表示)____________________________ (3)A与NaOH溶液反应的化学方程式(有机物用结构简式表示)
(3)A与NaOH溶液反应的化学方程式(有机物用结构简式表示)
(4)A在浓H2SO4作用下加热可得到B(B的结构简式为HO- - COOH),则B中既含有酚羟基又含有酯基的同分异构体共有______种,写出任意一种的结构简式
(4分)有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定量的这些烃,完全燃烧后生成m mol CO2和n mol H2O。则:
(1)当m=n时,该烃是 。 (2)当m=2n时, 该烃是 。
(3)当2m=n时,该烃是 。 (4)当4m=7n时,该烃是 。
短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2−离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)E元素的离子结构示意图为________。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为______、_______。
(3)A、B、C、D、中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L−1的X溶液与0.1mol·L−1的Y溶液等体积混合后,溶液呈碱性。请判断:
①X的化学式为 ,Y的化学式为 ;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
。
(1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)  2N2O5(g);
2N2O5(g);
若已知K350℃< K300℃,则该反应是_______反应(填“吸热”或“放热”)。
反应达平衡后,若再通入一定量NO2,则平衡常数K将______,NO2的转化率 (填“增大”、“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
① 写出该反应的平衡常数表达式:K= 。
② 1000 s内N2O5的分解速率为 。
③若每有1molN2O5分解,吸收QkJ的热量,写出该分解反应的热化学方程式 。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、Cl-、I-、NO3- 、SO42-、HCO3- ,取该溶液进行如下实验:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和稀硫酸,加热 |
有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加入足量 Ba(NO3)2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是  。
。
(2)为了进一步确定其它离子,应该补充的实验及应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细操作步骤)
(3)写出步骤(5)再当NaOH过量时沉淀部分溶解的离子反应方程式
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为_______ mol·L-1。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是_________(填序号)。
① 0.2 mol·L-1的CuSO4溶液 ② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl ④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_______(填序号)。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A ="===" H+ + HA- , HA- H+ + A2-。
H+ + A2-。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2-)>c( OH-)>c(HA-)>c(H+) OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____;
②当电解质溶液为浓硝酸时:
Cu电极是_____极,其电极反应为__________。
(2)请写出电解硫酸铜溶液的总化学方程式 。
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为: 。
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式: 。
(5)请根据下面所给出的5个热化学方程式,判断反应④的反应热ΔH4是________。
①NH3(g)+HCl(g)===NH4Cl(s) ΔH1=-176 kJ·mol-1
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1
③HCl(g)+H2O(l)===HCl(aq) ΔH3=-72.3 kJ·mol-1
④NH4Cl(s)+H2O(l)===NH4Cl(aq) ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH5=-52.3 kJ·mol-1
试题篮
()