已知:下列两个热化学方程式:
Fe(s)+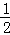 O2(g)═FeO(s)△H=﹣272.0KJ/mol
O2(g)═FeO(s)△H=﹣272.0KJ/mol
2Al(s)+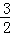 O2(g)═Al2O3(s)△H=﹣1675.7KJ/mol
O2(g)═Al2O3(s)△H=﹣1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是 .
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
根据图回答下列问题: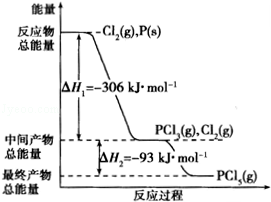
(1)P和Cl2反应生成PCl3的热化学方程式为: .
(2)PCl5分解成PCl3和Cl2的热化学方程式为: .
上述分解反应是一个可逆反应.温度为T1时,在密闭容器中加入0.80mol PCl5,反应平衡时PCl5还剩0.60mol,其分解率等于 .
(3)P和Cl2分两步反应生成1mol PCl5的△H3= ,P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”、“小于”或“等于”).
(4)PCl5与足量水反应,最终生成两种酸,其化学方程式为: .
400K、1.01×105 Pa时,2 L烃A的蒸气能在m L氧气中完全燃烧,反应后体积增至(m+4)L(体积在同条件下测定。)
(1)烃A的组成上应满足的条件是 。
(2)当m=15时,该烃可能的分子式为 。
(3)若A在常温常压下为气态,m的取值范围是 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L的H2SO4溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。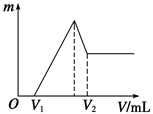
(1)当V1=140 mL时,则金属粉末中:n(Mg)=________mol,V2=_______ml
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=__________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,100 mL 2 mol/L 的H2SO4溶解此混合物后,再加入480 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3满足此条件的a的取值范围是_________。
除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Cu(Al)________________(2)Fe2O3(Al2O3)________________
(3)NO(NO2)__________________(4)NaCl溶液(Na2CO3)____________
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+K1
Fe(OH)2++H+K1
Fe(OH)2++H2O Fe(OH)2++H+K2
Fe(OH)2++H+K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O  CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
H2O(g)=H2O(l) △H=-44KJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式: 。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为 ,H2的浓度为 ,反应共放出或吸收热量 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为 。
Ⅰ、铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为_____________,
②图中A、B、C、D、四个区域,生成铁锈最多的是__________(填字母).
(2)已知:Fe(s)+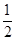 O2(g)═FeO(s)△H=-272kJ•mol-1
O2(g)═FeO(s)△H=-272kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
则高炉炼铁过程中FeO(s)+CO(g) Fe(s)+CO2(g)△H=__________。
Fe(s)+CO2(g)△H=__________。
Ⅱ、甲醇是一种重要的化工原料和新型燃料。下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.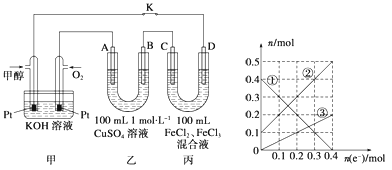
(1)甲中负极的电极反应式为__________。
(2)乙中A极析出的气体在标准状况下的体积为__________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3,则图中②线表示的是__________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________mL 5.0mol•L-1 NaOH溶液。
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是____________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有____________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓H2SO4 |
(1)0.5 mol CO2的质量为___________,其中含有__________个CO2分子,在标准状况下的体积是 。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为____________。
(3)想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这三种物质为什么可以归为一类,下列哪些物质可以和它们归为一类 (填序号)。
A 75%的酒精溶液 B硝酸钠 C碱石灰 D豆浆 E过氧化钠
(4)洁厕灵(强酸性,含盐酸)与84消毒液(碱性,含NaClO)混用可能使人中毒。请写出中毒涉及反应的离子方程式 。
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。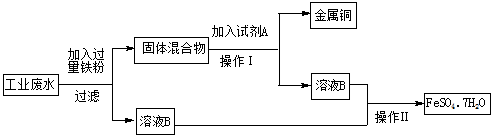
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下: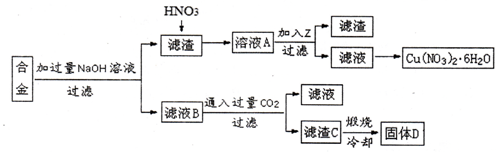
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
铝、铁是重要的金属,其单质及化合物有着广泛的应用,完成下列填空:
(1)铝元素在周期表中的位置是 ,写出其最高价氧化物对应水化物的电离方程式 。
(2)画出铁原子的结构示意图 。与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为 。
(3)在FeC13稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;在其中加入少量KCl固体,溶液的颜色 (选填“变深”,“变浅”或“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加溶液,则不呈红色,若再加入足够量FeC13溶液,又会呈现红色。请试对上述实验现象作出解释 。
铁、铝是应用最广泛的两种金属。完成下列填空:
(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,它们互称为 ,其中58Fe原子中子数与质子数之差为 。
(2)工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁 。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出该反应的化学方程式 ,该反应是 (填“吸”或“放”)热反应。
(4)铁粉中混有少量的铝粉,请设计一种实验方案除去铁粉中的铝粉
(5)向某溶液中投入铝片后有大量的H2放出,溶液中不可能大量存在的离子是 (填序号)
a.Cl- b.H+ c.OH- d.HCO3-
(6)铁与稀硝酸反应的方程式如下:3Fe+8HNO3 →3Fe(NO3)2+2NO↑+4H2O
该反应的氧化剂是 ,氧化产物是 ,每转移1.8mol电子,生成NO L(标准状况)。
试题篮
()