如图所示的电解装置中,乙池盛有200mL饱和CuSO4溶液,丙池盛有200mL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则:

(1)P是电源的_________极。甲池中,A极的质量_________g。电解一段时间,甲池溶液的pH为_________。(2)D极的电极反应式为 ,丙池电解反应的总离子方程式为 。
相同状况下,D电极与E电极产生的气体体积比为_______________。
(3)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为__________________。(用NA表示)
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中c(H+)/c(OH-)=___________________。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_______。该温度___________25℃。
(3)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=____________
②若所得混合液的州pH=10,且a=12,b=2,则Va:Vb=____________
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀的pH |
1.9 |
7.0 |
4.7 |
| 完全沉淀的pH |
3.2 |
a |
6.7 |
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10﹣5mol/L时,沉淀就达到完全。已知Fe(OH)2的Ksp约为1.0×10﹣15,则a= 。
(2)加入氧化剂的目的是 ,X应选择 。
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O。简要描述实验步骤 。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)。
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)。
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填>、<、=、无法确定)。
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验: 在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=" -" 49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=" -" 49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率
v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 |
| D.再充入1molCO2和3molH2 |
④在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________________。
⑤我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。写出该电池负极的电极反应式__________________________。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤:

(1)请写出上述实验中加入或生成的有关物质的化学式:
③ ④ ⑤ ⑥
(2)合并溶液通入⑥的离子反应方程式________________ 。
(3)若向废液中加入任意质量的①物质,下面对充分反应后的溶液分析合理的是
| A.若无固体剩余,则溶液中一定有Fe3+ |
| B.若有固体存在,则溶液中一定没有Cu2+ |
| C.若溶液中有Cu2+,则一定没有固体析出 |
| D.若溶液中有Fe3+,则一定还有Cu2+ |
(4)若向②中加入氢氧化钠溶液,其实验现象为 。
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g) 2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:

则1mol N﹣H键断裂吸收的能量约等于 。
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是 。
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2。请由总反应式回答:
2Ni(OH)2。请由总反应式回答:
1.电解质溶液应该是 (选填酸溶液、碱溶液),
②.电池放电时,负极反应式为 ,
3.外电路中每通过0.2NA个电子时,H2的质量理论上减小 g,
4.电池工作时,电子由 极通过外电路流向 极(选填正、负)。
研究发现,含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(1)雾霾中能形成酸雨的物质是_____________。
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
N2(g)+O2(g) 2NO(g) △H =" +180.50" kJ·mol-1
2NO(g) △H =" +180.50" kJ·mol-1
①下列表示NH3(g)与NO(g)在一定条件下反应,生成无污染气体的能量转化关系示意图正确的是:___________(填字母)

② 右图是反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。
5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。

(3)右图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,

① 阴极的电极反应式是 。
② 物质A是_____________(填化学式),理由是_________________________。
(4)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:

① 随空/燃比增大,CO和CxHy的含量减少的原因是 。
② 当空/燃比达到15后,NOx减少的原因可能是_____________。
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl是白色固体,难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以硫化铜精矿为原料生产CuCl的工艺过程如下:
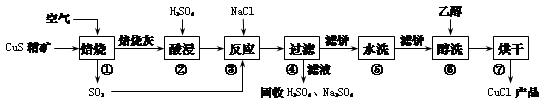
回答下列问题:
(1)CuS精矿经250 ℃低温焙烧后生成CuO,步骤②中主要反应的离子方程式是 。
(2)步骤③先加NaCl、通入SO2时无沉淀,加水稀释就产生大量白色沉淀,其原因是 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______(写名称);步骤⑥醇洗的作用是 。
(4)已知25℃,101 kPa时:S(s)+O2(g)==SO2(g) ∆H=-296.8 kJ/mol
2Cu(s)+O2(g)==2CuO(s) ∆H=-314.6 kJ/mol
Cu(s)+S(s)==CuS(s) ∆H=-53.1 kJ/mol
步骤①中CuS与O2反应的热化学方程式是 。
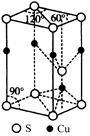
(5)CuS晶胞结构如图所示,其中含有硫原子的数目是 。
(6)假设上述①~③步反应完全转化,④~⑦步操作共损失产品3.5%,反应生成的硫酸全部被循环利用,则生产100 kg 96.5%的CuCl(Mr=99.0)产品,除循环利用之外,需要处理的尾气中含SO2 m3(标准状况)。
(利多卡因是医用临床常用的局部麻药,其一种合成路线如下:

已知:Ⅰ.R OH
OH R
R Cl Ⅱ.
Cl Ⅱ.
请回答下列问题:
(1)A分子中碳原子的杂化轨道类型有 ,D的名称为 。
(2)C的结构简式为 ,⑥的反应类型是 。
(3)反应③的化学方程式为 。
(4)写出G与NaOH溶液在加热条件下反应的化学方程式: 。
(5)E存在多种同分异构体,写出满足下列条件的所有同分异构体的结构简式: 。
a.能使Br2的CCl4溶液褪色,遇FeCl3溶液显色 b.含有-NH2,苯环上只有1种氢
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0 (Ⅰ)
TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2的晶体,则温度T1______T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______________,滴定反应的离子方程式为___________________。
(4)25 ℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)在步骤②-③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为 。
A 1.5 B 3.7 C 9.7 D 氨水 E 氢氧化锶粉末 F 碳酸钠晶体
(3)操作③中所得滤渣的主要成分是 (填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是 。
试题篮
()