(1)人们常用催化剂来选择反应进行的方向,左图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
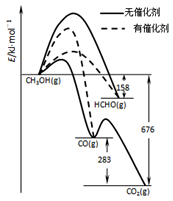
①写出1moL HCHO与O2发生反应时生成CO和H2O(g)的热化学方程式_______________;
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是_______________;
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)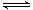 3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
A.混合气体密度保持不变 B.2v正(NO2)=3v逆(N2)
C.N2H4与NO2体积比保持不变 D.体系压强保持不变
②在某温度下,10L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 |
n (N2H4) |
n (NO2) |
n (N2) |
| 起始 |
2.0 |
3.0 |
0 |
| 第2min |
1.5 |
a |
0.75 |
| 第4min |
1.2 |
b |
1.2 |
| 第6min |
1.0 |
c |
1.5 |
| 第7min |
1.0 |
c |
1.5 |
ⅰ前2min内NO2的平均反应速率为_____________(保留2位有效数字,下同)该温度下反应的平衡常数K=___________________。
ⅱ关于上述反应,下列叙述不正确的是_____________。
A.达到平衡时,移走部分N2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡向右移动,c(N2H4)将变大
C.在相同条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,应选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入He,则此时v(逆) >v(正)
ⅲ.请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图(在图上注明变化的条件)。
如下图所示:
(1)a电极是_________(填“阴极”或“阳极”),b电极是_________(填“阴极”或“阳极”)。
(2)当电解NaCl溶液时:
①a电极的电极反应为________________,该反应是_______(填“氧化”或“还原”)反应;
②b电极的电极反应为______________,该反应是_________(填“氧化”或“还原”)反应。
(3)当电解精炼铜时:
①a电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________;
②b电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________。
根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
_____________________________________。
(2)下图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为: 。

某温度(T℃)下的溶液中,c(H+)=10﹣x mol·L﹣1,c(OH﹣)=10﹣y mol·L﹣1,x与y的关系如图所示,请回答下列问题:
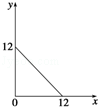
(1)此温度下,水的离子积Kw为 ,则该温度T 25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
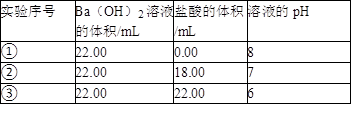
假设溶液混合前后的体积变化忽略不计,则a= ,实验②中由水电离产生的c(OH﹣)= mol·L﹣1.
(3)在此温度下,将0.1mol·L﹣1的NaHSO4溶液与0.1mol·L﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
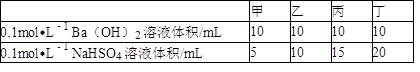
①按丁方式混合后,所得溶液显 (填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②B的空间构型是 (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是 。
2NH3实现储氢和输氢。下列说法正确的是 。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+中,N原子是配位原子
d.CN-的电子式为[∶C︙︙N∶]-
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。
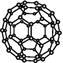
C60分子结构
①C60晶体易溶于苯、CS2,说明C60是 分子(选填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为 。
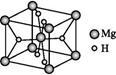
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为 cm3[用a、NA表示(NA表示阿伏加德罗常数的数值)]。
(1)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
|
| a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol· L-1 FeCl3溶液 |
| b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol· L-1 FeCl3溶液 |
| c |
50 mL 5% H2O2溶液 |
少量浓 NaOH溶液 |
1 mL 0.1 mol· L-1 FeCl3溶液 |
| d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。

由该图能够得出的实验结论是__________________________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因:_______________________________。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0 ,
TaI4(g)+S2(g) ΔH>0 ,
①反应的平衡常数表达式K=________ ,若K=1,向某恒容密闭容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。

图3
②如图3所示,上面反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。

(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
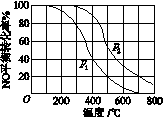
①比较p1、p2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
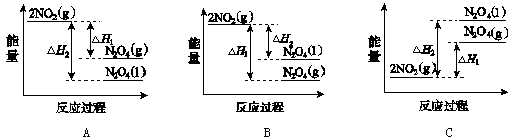
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是 (选填字母)。
②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
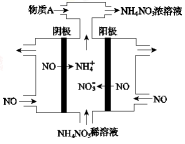
为使电解产物全部转化为NH4NO3,需补充A。A是 ,说明理由: 。
某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
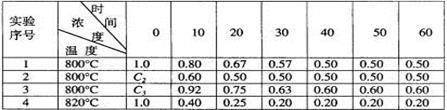
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为______________mol/(L·min)。
(2)在实验2,A的初始浓度C2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1,且C3 1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由_____________。
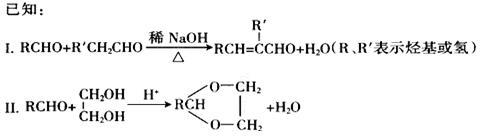
合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如下图(部分反应条件和产物略去)。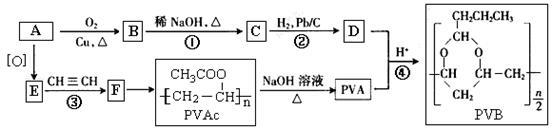
请回答:
(1)A为饱和一元醇,其氧的质量分数约为34.8%,A的化学名称为_____________,PVA的结构简式为_________________。
(2)C中官能团的名称是____________,C的名称_________________,A~F中核磁共振氢谱出峰最多的是________________(填化合物代号)。
(3)反应①包含的反应类型是_________________;反应④的化学方程式为_________。
(4)PVAc是由F加聚而成,与F具有相同官能团的同分异构体还有_______种;写出其中一种的结构简式:________________。
已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45%~50%),另一个产物A也呈酸性,反应方程式如下:

(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1:1,产物A的名称是 。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为 。
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
| 取代苯甲醛 |
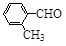 |
 |
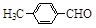 |
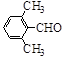 |
| 产率(%) |
15 |
23 |
33 |
0 |
| 取代苯甲醛 |
 |
 |
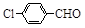 |
 |
| 产率(%) |
71 |
63 |
52 |
82 |
可见,取代基对Perkin反应的影响有(写出3条即可):
①________________________________
②___________________ _
③________________________________
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯(PbCl2)催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为 。
(5)Beck反应中的有机产物不能发生的反应是__________(填字母)。
(A)加成反应 (B)取代反应 (C)氧化反应 (D)消去反应
有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为: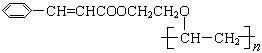 。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。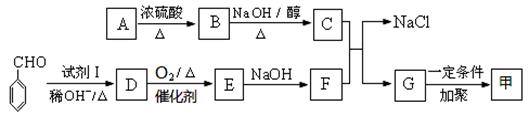
已知:①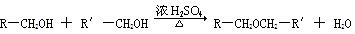
②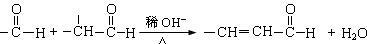
回答下列问题:
(1)试剂Ⅰ的名称是_________;B→C的反应类型是____________。
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶2∶1,则A的结构简式为_______________。
(3)写出下列反应的化学方程式。
①D→E的反应 __________________________。
②C与F的反应 _________________________。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加到饱和溴水中后,有白色沉淀生成,该物质的结构简式为 _________________。
碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂。DMC的合成路线如下图。完成下列填空。
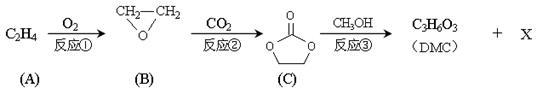
已知: RCO-OR1 + R2O-H→RCO-OR2 + R1O-H (称酯交换反应)
(1)写出反应类型:反应①________ ;反应③ _________ ;
(2)写出结构简式:DMC__________;X___________;
(3)已知物质Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2 molY能生成1mol分子中含六元环结构的有机物Z,则Y的结构简式为________,Z的结构简式为________;
(4)DMC与双酚( )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:_______________________。
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:_______________________。
2014年4月,英国《每日邮报》报道制造太阳镜、婴儿奶瓶、太空杯和光盘的主要材料都是聚碳酸酯,聚碳酸酯在一定条件下可释放出有毒的双酚A(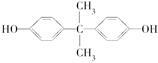 )。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
Ⅰ.下列关于双酚A的说法不正确的是________(填序号)
A.利用聚碳酸酯制成的茶杯来泡茶时对人体无害
B.双酚A的分子式是C15H16O2
C.双酚A的核磁共振氢谱显示有4组峰,且峰面积之比为1∶2∶2∶3
D.1 mol双酚A最多消耗2 mol Br2
Ⅱ.聚碳酸酯(简称PC)是分子链中含有碳酸酯基的高分子聚合物,其合成流程如下: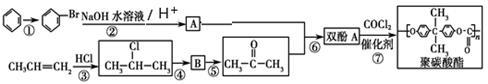
(1)反应①②③④⑤中属于取代反应的有________。
(2)CH3CH==CH2与Cl2加成产物的同分异构体有________种(不含加成产物)。
(3)写出反应⑤⑦的化学方程式:
反应⑤________________________。反应⑦________________________。
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,其合成路线如下: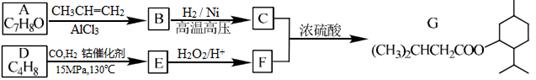
已知:
①A能与FeCl3溶液发生显色反应
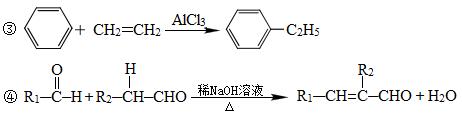
(1)A的结构简式为____________。
(2)C烃基上的一氯代物有种(不考虑立体异构)____________。
(3)D分子中含有种不同化学环境的氢原子____________。
(4)写出同时符合下列条件的A的所有同分异构体的结构简式(不考虑立体异构):____________。
a.分子中有6个碳原子在一条直线上
b.分子中含一个—OH
(5)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任用)。合成路线流程示意图示例如下:
A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示: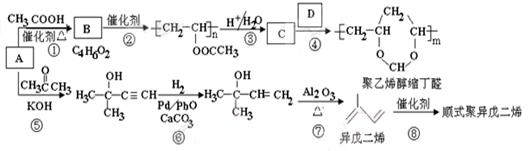
回答下列问题:
(1)A的名称是,B含有的官能团是_________。
(2)①的反应类型是_________,⑦的反应类型是_________。
(3)C和D的结构简式分别为____________、____________。
(4)异戊二烯分子中最多有个原子共平面,顺式聚异戊二烯的结构简式为____________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体(填结构简式)____________。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线。
试题篮
()