部分弱酸的电离平衡常数如表:
| 弱酸 |
HCOOH |
HNO2 |
H2S |
H2SO3 |
H2C2O4 |
| 电离平 衡常数 (25℃) |
K=1.8×10﹣4 |
K=5.1×10﹣4 |
K1=9.1×10﹣8 K2=1.1×10﹣12 |
K1=1.23×10﹣2 K2=6.6×10﹣8 |
K1=5.4×10﹣2 K2=5.4×10﹣5 |
(1)请写出HNO2的电离方程式 。
(2)上表的5种酸进行比较,酸性最弱的是:_______________;HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是 。
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH—先后消耗的酸及酸式酸根依次是:_______________________。
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:__________________。
(5)下列离子方程式书写正确的是 。
A.HNO2 + HS— ="=" NO2—+ H2S↑
B.2HCOOH+SO32— ="=" 2HCOO—+H2O+SO2↑
C.H2SO3+2HCOO— ="=" 2HCOOH+SO32—
D.H2SO3+ SO3 2— ="=" 2HSO3—
E.H2C2O4+ NO2—="=" HC2O4—+ HNO2
(6)已知HX为一元弱酸。某混合溶液中含有4mol NaX、2mol Na2CO3和1mol NaHCO3。往溶液中通入3mol CO2气体,充分反应后,气体全部被吸收,计算某些物质的量:
Na2CO3 _。NaHCO3 。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
T2 |
| 水的离子积常数 |
1×10-14 |
1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
| 难溶物 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
| Ksp |
8.0×10-16 |
8.0×10-38 |
1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
4 |
9.0 |
6.7 |
(1) 最适合作氧化剂X的是__________,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________。
(3)加入的物质Y是___(写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有_______。
M是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构为
 。(不考虑立体结构,其中R为
。(不考虑立体结构,其中R为  ),M的一种合成路线如下(部分反应试剂和条件省略)。
),M的一种合成路线如下(部分反应试剂和条件省略)。

完成下列填空:
(1)写出反应类型: 反应①_____________,反应③_________________;
(2)写出反应试剂和反应条件:反应②_________________ , 反应④____________________;
(3)写出结构简式:B_____________________, C_________________________;
(4)写出一种满足下列条件A的同分异构体的结构简式
a.能与FeCl3溶液发生显色反应;
b.能发生银镜反应;
c.分子中有5种不同化学环境的氢原子
_____________________________________________________________。
(5)丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。(合成路线常用的表示方式为: )
)
__________________________________________________________________________。
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液。这九种物质间反应的转化关系如图所示

(1)写出四种单质的化学式
A________ B_______ C______ D______
(2)写出H+B→G的离子方程式 ;
(3)写出G+I→H+D+E的化学方程式 ;
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.2mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2 =Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 保留到小数点后两位)。
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
(1)①的反应类型是__________;③的反应类型是__________。
(2)②的化学方程式为_______________________________________________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为__________________________。
(5)I的结构简式为__________________。
(6)下列说法正确的是________(填字母序号)。
a. B和D互为同系物 b. ⑦为酯化反应 c.D可以和灼热的CuO发生反应
(7) (C10H10O4)的同分异构体中,满足下列条件的有____________种。
(C10H10O4)的同分异构体中,满足下列条件的有____________种。
①能与NaHCO3溶液反应,0.1mol该同分异构体能产生4.48L(标况)CO2气体;
②苯环上的取代基不超过三个;③苯环上的一氯代物只有两种。
短周期元素形成的纯净物A、B、C、D、E之间的转化关系如下图所示,A与B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同)。
请回答下列问题:
(1)若A是气态单质,D是一种强碱。
①B的化学式为________或__________。
②C的电子式为________。
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因_____________________。
②用等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系_______________。
(3)若C是一种气体,D是一种强酸。
①写出C与水反应的化学方程式为______。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用如图所示装置进行实验。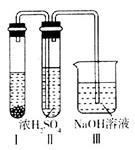
装置I中的试剂为_______;实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是______________。
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
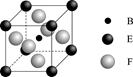
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是______________.
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
I.甲、乙、丙三种物质之间有如下转化关系:

甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液.
(1)则甲是______,丙是________(填化学式)。
(2)写出“ ”转化的离子方程式:__________。
”转化的离子方程式:__________。
II.右图表示A——E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物。
(1)写出③、⑧的化学方程式:③______________; ⑧_____________________.
(2)写出反应④的离子方程式:___________________。

下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
(1)写出无色溶液中溶质的化学式: ;写出E的电子式 。
(2)写出C到白色沉淀的化学方程式是 。
(3)反应F→D的离子方程式是 。
某芳香烃X是一种重要的有机化工原料,分子式C7H8。现以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,F的分子式为C7H7NO2,Y是一种功能高分子材料。
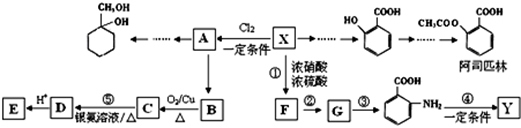
已知下列信息:
(1)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基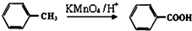
(2)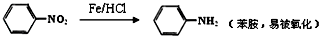
请根据本题所给信息与所学知识回答下列问题:
(1)X的结构简式是 ,其核磁共振氢谱图有 个吸收峰;
(2)有机物C的结构简式是 ;
(3)阿司匹林分子中含有的官能团的名称是 ;1mol阿司匹林与足量NaOH溶液反应最多消耗NaOH的物质的量为 mol;
(4)Y的结构简式为 ;
(5)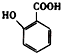 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
(6)以下是由A和其他物质合成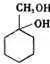 的流程图,
的流程图,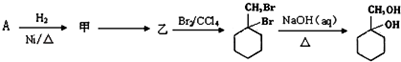 。
。
甲→乙反应的化学方程式为 .
试题篮
()