m、n、x、y四种主族元素在周期表里的相对位置如下所示,已知它们的原子序数总和为46。
| m |
n |
|
|
| |
|
x |
y |
(1)m与y形成的化合物中含 键,属 分子(填“极性”或“非极性”)。
(2)由n、y的氢化物相互作用所生成的物质的电子式为 。
(3)写出m单质与x元素最高价氧化物对应的水化物反应的化学方程式为
。
(4)核电荷数比x元素少8的元素可形成多种粒子,按要求填入空格中:
| 质子数 |
16 |
16 |
16 |
| 电子数 |
16 |
17 |
18 |
| 化学式 |
|
|
|
(8分)有甲、乙、丙、丁四种分散系,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
(1)电泳:甲的阳极周围颜色变浅,阴极周围颜色变深。
(2)将一束光通过乙液体,无丁达尔效应。
(3)将乙液体加入到丙液体中,先出现聚沉,后溶液变清。
则甲为;乙为;丙为;丁为。
在下图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题: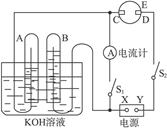
(1)标出电源的正、负极:X为___________极,Y为___________极。
(2)在滤纸的C端附近,观察到的现象是_______________________________________,在滤纸的D端附近,观察到的现象是_________________________________________________。
(3)写出电极反应式:A中_____________________。B中___________________________。
C中_________________________。D中_________________________。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2,闭合开关S1,则电流计的指针是否发生偏转(填“偏转”或“不偏转”)__________。
(5)若电流计指针偏转,写出有关的电极反应式(若指针“不偏转”,此题不必回答):
A极_______________________________________________________。
B极_______________________________________________________。
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答)
_____________________。
某蓄电池因使用日久而正、负极标志模糊。请根据另外找到的下列两组器材和试剂,回答两种判断该蓄电池的正、负极的方法。
(1)氯化铜溶液,两根带有铜导线的碳棒。
(2)硫酸铜溶液,两根铜导线。
已知有机物A分子中含有苯环且只有一个侧链。有机物A的相对分子质量M不超过200,其中氧元素的质量分数为26.7%,完全燃烧只生成水和二氧化碳。与之有关的有机物转化关系如下:(注意:部分反应产物省略)
(1)有机物A中含有官能团的名称分别为________________,A的分子式为____________。
(2)有机物C的结构简式为________
(3)有机物A~F中互为同分异构体的有____________和______________(填写序号)
(4)有机物A~F中不能使溴的四氯化碳溶液褪色的有_________________(填写序号)
(5)16.2g有机物BCD组成的混合物完全燃烧,得到的CO2通入3mol/LNaOH溶液中得到的产物为________________。
(6)写出A+D生成E的化学方程式_____________________________。
已知有机物A~I之间的转化关系如图所示:
①A与D、B与E、I与F互为同分异构体
②加热条件下新制Cu(OH)2悬浊液分别加入到有机物I、F中,I中无明显现象,F中变砖红色。
③C的最简式与乙炔相同,且相对分子质量为104
④B的一种同分异构体与FeCl3发生显色反应。
根据以上信息,回答下列问题:
(1)C中含有的官能团名称为
(2)H的结构简式为
(3)反应①~⑨中属于取代反应的是
(4)写出反应⑥的化学方程式
(5)写出 F与新制Cu(OH)2悬浊液反应的化学方程式
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3发生显色反应的G的同分异构体有
种.
物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。 
试回答下列有关问题:
(1)A在元素周期表的位置 周期 族
(2)以上7个化学反应属于非氧化还原反应的是 (用编号①→⑦填写)
(3)写出反应①是 ;
(4)写出引发反应④的实验操作
写出该反应一种重要的工业用途
(5)反应⑤的化学方程式是 。
(5)写出用A与H作电极材料插入G溶液闭合电路后的正极反应式是
。
有X、Y、Z、W四种短周期元素原子序数依次增大,它们之间可以同时相互形成A2B2型、AB型、A2型、A22—型等具有相同电子数的微粒。
(1)当A2型微粒为空气的主要成分时:
①写出上述A22—型微粒电子式 _______________。
②写出四种元素原子按5:1:1:3形成的离子化合物与足量NaOH反应的离子方程式_______________。
(2)当A2型微粒为最活泼的单质时:
①1mol A2B2型化合物分解转移电子的物质的量为_______。
②任写出一种具有相同电子的其他非极性分子的有机物化学式__________
③比较Z与W两种元素的氢化物的沸点与水溶液的酸性。沸点________________酸性______________。
现有E、F、H、I、G、K六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,E、G同主族,F、H、I为同周期相邻的三种元素,其中F元素形成的化合物种类是所有元素中最多的,I、G简单离子具有相同的电子层结构,K与F形成的离子化合物Q与E和I形成的常见共价化合物R之间的反应是实验室常见的可燃气体制备原理。(题中的字母只代表元素代号,与实际元素符号无关),请回答下列问题:
(1)E~K六种元素原子,原子半径第三大的是 (填对应的元素符号,下同)。
(2)E与H两种元素组成一种阳离子,该离子的结构式为 。
(3)I、G两种元素组成含有两种化学键的化合物,该化合物的电子式为
。
(4)下图为常温下向25mL 0.1 mol·L-1由E、I、G组成的化合物W溶液中逐滴滴加0.2 mol·L-1E、F、I组成相对分子质量为60的一元酸Z溶液过程中溶液pH的变化曲线。 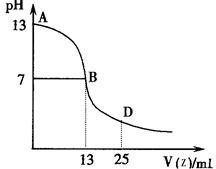
①上图能确定Z为 (“强”或“弱”)酸,理由是
②B点溶液呈中性,有人据此认为,在B点时W与Z恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
(5)写出Q与R之间的化学反应方程式 。
机动车尾气(含有烃类、NO、CO2、CO、SO2等物质)是城市大气污染的主要污染源之一,对汽车尾气的治理方法之一是在汽车的排气管上安装“催化转换器”(用Pt、Pd合金作催化剂),使NO和CO反应生成可参与生态环境循环的气体,并促使烃类燃烧及SO2的转化。请据此完成下列问题:
(1)机动车尾气可导致的环境污染有( )
①温室效应 ②臭氧层损耗 ③酸雨 ④光化学烟雾 ⑤白色污染
| A.①② | B.①②③ | C.①②③④ | D.①②③④⑤ |
(2)写出NO和CO反应的化学方程式_______________________________________________。
(3)“催化转换器”在一定程度上提高了空气的酸度,其原因是
___________________________。
医用葡萄糖氯化钠注射液的制备流程可简单表示如下:
自来水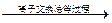 纯水
纯水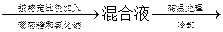 注射液
注射液
综合上述流程,完成下列问题:
(1)医用葡萄糖氯化钠注射液在配制的过程中,必须严格控制其中葡萄糖含量为5%、氯化钠含量为0.9%,之所以要确保氯化钠含量不过高或过低,原因是
_______________________。
(2)生产过程中需要高温处理混合液的目的应该是
___________________________________。
(3)注射液中加入葡萄糖的目的是向病人提供能量,请写出葡萄糖在人体内进行有氧分解代谢的化学方程式
________________________________________________________________。
(10分)日常生活中有许多看似不显眼,却能够提供多种信息的材料,食品标签便是其中一种。
| 品名:×××梳打饼干 _________:小麦粉、食用植物油、麦芽糖、食盐、疏松剂、鸡全蛋粉、酵母、全脂奶粉、食用香精、酵母提取物、氟亚硫酸钠 净含量:400克 _________:九个月 生产日期:2006-04-17 保存方式:避免日晒,置阴凉干燥处 产品标准号:0/XOMR2 生产厂家:上海××饼干食品有限公司 地址:中国上海市××路××号 由编:200033 电话号码:(86-25)3414×××× |
(1)请将上边的食品标签补充完整。
(2)这包食品最迟应在_________之前食用。
(3)如果该食品有质量问题,你维权的办法是:
①_____________________________________________;
②___________________________。(可以只答一条)
试题篮
()