化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
| A.节日期间燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| C.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| D.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;
② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。

将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L的H2SO4溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。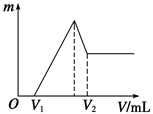
(1)当V1=140 mL时,则金属粉末中:n(Mg)=________mol,V2=_______ml
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=__________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,100 mL 2 mol/L 的H2SO4溶解此混合物后,再加入480 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3满足此条件的a的取值范围是_________。
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
(1)有关钠反应的现象是__________________________。
(2)大试管的溶液中出现的现象:____________________________。
(3)装置中液面的变化:大试管内___________;长颈漏斗内____________。
(4)写出钠与硫酸亚铁溶液反应的化学方程式:____________________。
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为______________。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________。
除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Cu(Al)________________(2)Fe2O3(Al2O3)________________
(3)NO(NO2)__________________(4)NaCl溶液(Na2CO3)____________
已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是( )
| A.O2和S2O32-是氧化剂,Fe2+是还原剂 |
| B.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
| C.每生成1 mol Fe3O4 ,转移电子的物质的量为2 mol |
| D.参加反应的氧化剂与还原剂的物质的量之比为1∶1 |
甲、乙、丙、丁分别是氢氧化钡溶液、氯化钾溶液、碳酸钠溶液、硝酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
| A.乙一定是氯化钾溶液 | B.甲一定是氢氧化钡溶液 |
| C.丙不可能是碳酸钠溶液 | D.丁只能是硝酸 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA |
| B.标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| C.92 g NO2和N2O4的混合气体中含有的原子总数为6NA |
| D.100g 17%的氨水,溶液中含有的NH3分子数为NA |
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.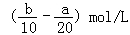 |
B.(2b﹣a)mol/L |
C.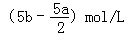 |
D.(10b﹣5a)mol/L |
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A.K+、 AlO2-、 Cl-、SO42- | B.H+、Ba2+、Cl-、NO3 |
| C.Ca2+、Fe2+、 NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
| A.0.336L | B.0.224L | C.0.168L | D.0.504L |
50ml 18.4mol/L硫酸与足量的铜片加热反应,被还原的硫酸的物质的量是( )
| A.0.92mol | B.大于0.46mol,小于0.92mol |
| C.0.46mol | D.小于0.46mol |
试题篮
()