在中央电视台发布的重点城市空气质量日报中可以看到,造成空气污染的首要污染物是可吸入颗粒物、二氧化硫、一氧化碳。下列对其形成的主要原因分析不合理的是
| A.生活污水的随意排放 |
| B.生活生产中以原煤为原料 |
| C.植被破坏,粉尘随风飘扬 |
| D.汽车排放的尾气 |
请从H、N、O、K四种元素中选一种或几种,写出符合下列要求的化学符号。
(1)两个氢分子 (2)一种金属阳离子 (3)相对分子质量最小的氧化物
(4)一种碱 (5)一种复合肥料
在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是
| A.反应后物质M的质量为13g | B.物质Q可能是该反应的催化剂 |
| C.反应中N、P的质量比为5:4 | D.该变化的基本反应类型是分解反应 |
小王同学需配制100g 12%的NaOH溶液来制作“叶脉书签”。在配制溶液过程中,下列做法正确的是
| A.在托盘上垫上纸并称取12g NaOH固体 |
| B.称量时发现指针向右偏转,应调节游码使天平平衡 |
| C.用100mL量简量取88mL水 |
| D.把称取的NaOH固体直接倒入装有88mL水的量筒中溶解 |
下列说法正确的是
| A.金刚石、石墨和C60都是由碳原子构成的单质 |
| B.铁锈覆盖在铁的表面,保护里层的铁不再与氧气反应 |
| C.生铁的含碳量比钢高 |
| D.pH为6的雨水属于酸雨 |
下列各组离子在水中一定能大量共存,并形成无色透明溶液的是
| A.NH4+、H+、NO3- | B.H+、Na+、HCO3- |
| C.Fe2+、OH-、SO42- | D.K+、H+、MnO4- |
有a、b、c三种金属,a能从b的硝酸盐溶液中置换出b,但a不能与稀盐酸反应; c能与稀盐酸反应产生H2。a、b、c的金属活动性由强到弱的顺序为
| A.a、b、c | B.a、c、b | C.c、a、b | D.c、b、a |
(7分)下列两组装置图都与我们学过的气体的制取和性质有关.
(1)根据如图(A~E)所给的装置,回答问题:
①实验室用高锰酸钾制取氧气,可选用的发生装置为________,已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置 (填字母序号)。
②实验室制取二氧化碳,可选用的发生装置为 ,验满方法是__ _____.
(2)在实验室中,集气瓶被称做“万能瓶”,用它可以组装成各种用途的装置,请仔细观察下列(F~K)各个装置的特点回答问题:
①实验室若用F装置收集氧气,则氧气应从口进入_______(填导管口符号).
②若要收集一定体积的二氧化碳气体,应选用装置_______.
③若要除去一氧化碳中的微量二氧化碳,同时用该瓶收集较纯净的一氧化碳,应选用装置______.
(9分) (1)按下列要求选择序号填空。
A. CH4 B.2Fe3+ C.CO32- D.3O3 E.OH- F.C2H5OH G.3O2 H. 2Fe2+
①两个亚铁离子____________ ; ②天然气的主要成分__________ ;
③纯碱中的阴离子__________ ; ④ 3个氧分子____ _________。
⑵下图是某粒子的结构示意图。
①若该粒子为阳离子时,则m - 2____ x(选填“>”“<”或“=”);
②若该粒子为原子,且m = 3x时,则该元素属于____ 元素(填“金属” 或“非金属”);
(3)钢铁制品在 中易生锈;请写出一种防止铁生锈的方法 ,由于 不同,使得钢和生铁的坚韧性有较大差异。
实验室用氯酸钾和二氧化锰制取氧气,加热一段时间后剩余固体混合物10g,继续加热至完全反应后固体变为9.04g,再将固体加水充分溶解、过滤、干燥得到1.59g黑色固体。求10g剩余固体混合物中氯元素的质量分数为
| A.7.1% | B.35.5% | C.42.6% | D.28.4% |
截至2014年3月,江苏共有16例人感染H7N9禽流感确诊病例。目前研发的新药帕拉米韦(C15H28N4O4)已获得审批。下列关于帕拉米韦说法不正确的是
| A.帕拉米韦属于化合物 |
| B.帕拉米韦的相对分子质量是328 |
| C.帕拉米韦中碳、氢、氮、氧四种元素的原子个数比为15∶7∶1∶1 |
| D.帕拉米韦中碳元素的质量分数约为54.9% |
如图是实验室常用的两种气体制备、收集或净化的多种功能装置。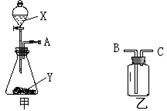
⑴甲中盛放试剂Y的实验仪器的名称是
⑵若制备的气体是氧气,Y是黑色粉末,则甲中发生反应的化学方程式为 。若用装满水的乙装置收集氧气,A端应与________(填“B”或“C”) 端相连。
⑶若X是稀盐酸、Y是石灰石,用甲、乙两装置组成发生、净化、收集CO2气体的系列装置。若乙中放入饱和的NaHCO3溶液,该溶液的作用是除去 ;若乙中放入浓硫酸,浓硫酸的作用是 。
(1)下面是关于某反应的微观示意图 ( “  ”和“
”和“  ”分别表示氮原子和氢原子 )
”分别表示氮原子和氢原子 )
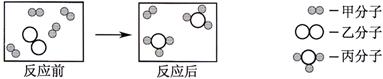
参加反应的甲分子和乙分子个数比为 ,该反应的反应类型是 反应
(2)元素周期表是学习和研究化学的重要工具,下列是元素周期表的一部分。
|
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
||
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
||
| 3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
其中,3—10号元素在第2周期,11—18号元素在第3周期。这些元素排在周期表的同一周期是因为它们的原子具有相同的
试题篮
()