下列关于空气及其成分的说法错误的是 ( )
| A. |
空气中各成分含量相对稳定 |
| B. |
含量过高影响人体健康 |
| C. |
用作粮食、瓜果的保护气 |
| D. |
可以支持所有的物质燃烧 |
在探究“铜绿”性质的实验中,下列操作错误的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
“端午到,粽香飘”。对闻到粽子香气的解释合理的是( )
| A. |
分子的数目变多 |
B. |
分子的体积变大 |
| C. |
分子在不断运动 |
D. |
分子发生了分解 |
下列常见物品所用材料属于无机非金属材料的是( )
| A. |
塑料脸盆 |
B. |
陶瓷花瓶 |
C. |
不锈钢刀叉 |
D. |
机动车轮胎 |
储存易燃物和易爆物的厂房需要有明显的安全标志。下列图标不属于消防安全标志的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
一种以甲烷为燃料、含铜氧化物为载氧体的化学链燃烧反应原理如下:

(1)科学利用燃烧为人类服务,有利于社会可持续发展。
①甲烷燃烧时, (填“吸收”或“放出”)热量。
②与传统燃烧方式相比,化学链燃烧可避免燃料和空气直接接触,有利于捕集 ,防止其大量排入空气,造成 。
(2) 进入燃料反应器与甲烷发生反应 ,生成的 再进入空气反应器,在一定温度下发生反应 (填化学方程式),实现载氧体的循环再生。
(3)已知:空气中 的体积分数约为21%。
从空气反应器排出的气体中 体积分数随反应温度变化关系如图所示。
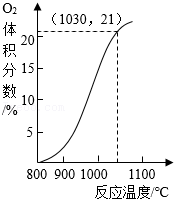
①在800~1100℃间,升高温度,排出的气体中 体积分数 (填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是 (填序号)。
A.800﹣900℃
B.900﹣1000℃
C.1000﹣1030℃
D.1030﹣1100℃
涂覆在铺路石表面的 可净化路面空气。实验室制备 的流程如下:
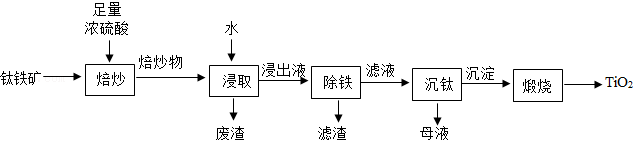
(1)焙炒时,钛铁矿的主要成分 在蒸发皿(如图)中发生反应 。实验中用沙浴加热,图中还缺少的玻璃仪器是 。

(2)焙炒物冷却后,加水溶解浸取。
①浸取时,水温易升高的原因是 。
②浸取后,混合物经 (填操作名称)弃去废渣,得到浸出液。
(3)浸出液除铁后,所得滤液中含 和 。
加热煮沸滤液, 和水反应生成 沉淀和 ,该反应的化学方程式为 。
(4)煅烧 沉淀得产品 。
整个实验流程中可循环利用的物质除水外,还有 。
钱老师设计了如图1所示的数字化实验指导同学们对铜铁锈蚀进行探究。用铁粉和碳粉的均匀混合物模拟铁钉成分,用传感器测定试剂瓶内气体的相关数据。
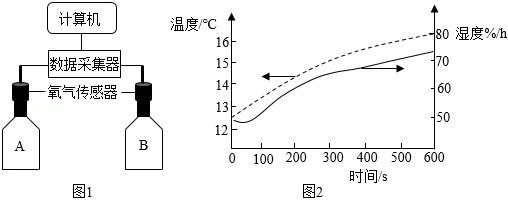
可供选择的药品见表:
|
组别 |
药品 |
||||
|
铁粉/g |
碳粉/g |
水/滴 |
食盐/g |
其他 |
|
|
一 |
5.0 |
0.1 |
0 |
0 |
干燥剂 |
|
二 |
5.0 |
0.1 |
10 |
0 |
无 |
|
三 |
5.0 |
0.1 |
10 |
1.0 |
无 |
|
四 |
5.0 |
0.1 |
0 |
1.0 |
无 |
(1)铁在空气中锈蚀生成铁锈。铁锈的主要成分是 (填化学式)。
(2)在A、B两只试剂瓶中依次加入第一组和第二组药品进行实验。
①600s内A瓶中 含量几乎不变,B瓶中不断减少。实验表明,铁在空气中锈蚀是铁和 、 发生了化学反应。
②将第二组药品中的水改为迅速冷却的沸水,且用量增多至足以完全浸没固体混合物。600s内B瓶中 含量也略有减少,主要原因是 。
(3)为探究食盐对钢铁锈蚀速率的影响,应选择的药品组别是 (填序号)。
(4)在两只试剂瓶中均加入第二组药品,分别改用温度和湿度传感器测得结果如图2所示。瓶内湿度随时间增大(即水蒸气含量增大),根本原因是 。
(5)请提出一种防止钢铁生锈的方法: 。
化学兴趣小组设计了如图所示两个装置,以 溶液为原料制备 ,可灵活控制气体的产生与停止。

(1)甲装置用 作催化剂,先用黏合剂将 粉末制成团状。
①仪器a的名称是 。
②团状 应放在 (填“试管底部”或“多孔隔板上”)。
③打开活塞K,经仪器a向试管中缓慢加入 溶液至浸没团状 ,立即产生 ,收集完后, (填操作),反应随后停止。
(2)乙装置用铂丝(可上下抽动)作催化剂。安全管下端浸没于 溶液中,将铂丝插入溶液,立即产生 。
①若烧瓶内压强过大,安全管中出现的现象是 。
②当出现上述现象时,应采取的措施是 。
(3)取100g 溶液加入乙装置的烧瓶中,完全反应后,测得生成2.56g 。计算 溶液的溶质质量分数(写出计算过程)。
在初中化学“金属的性质”中有如下实验:将无锈铁钉浸入 溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
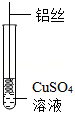
【提出问题】 和 溶液也能发生化学反应吗?
(1)预测 能和 溶液反应,理由是 。
【进行实验】将一端缠绕的铝丝浸入 溶液(如图),观察现象。
(2)铝丝表面未出现红色物质,原因是 。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入 溶液,观察现象。
(3)填写实验报告单:
|
序号 |
实验现象 |
结论与解释 |
|
1 |
铝丝表面有少量气泡; 铝丝周围出现蓝绿色物质 |
溶液呈弱酸性,与 反应产生的气体是 ,蓝绿色物质成分待探究 |
|
2 |
24h后,铝丝仍光亮; 48h后,铝丝表面出现少量红色物质 |
红色物质是 ,说明 能和 溶液反应,但反应较慢 |
|
③ |
铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色; 两层溶液界面清晰 |
反应生成的 为无色; 溶液的密度 (填“>”或“<”) 溶液 |
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:① 呈蓝绿色,不溶于水;
② 可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为 。
(5)欲加快 和 溶液的反应,可加入的物质是 (填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是 (填序号)。
| A. |
食醋 |
| B. |
食用油 |
| C. |
面粉 |
| D. |
咸菜 |
侯德榜发明的侯氏制碱法为中国民族化学工业赢得了声誉。
(1)侯氏制碱的主要产品是 ,其俗名是 。
(2)实验室模拟侯氏制碱,在浓氨水中加入 粉末,配成饱和氨盐水,用下列装置制备 ,反应为 。

①甲装置中发生反应的化学方程式为 。
②乙装置中试剂 可吸收 ,但不与 反应,气流的进气接口为 (填“b”或“c”)。
③上述四个装置的连接顺序为 (填序号)。
| A. |
甲乙丙丁 |
| B. |
甲乙丁丙 |
| C. |
甲丙丁乙 |
| D. |
甲丁丙乙 |
(3)分离丁装置U形管内的混合物得到 固体和 溶液。
①灼烧 发生反应 ,若灼烧前后固体质量减少1.24g,则产品 的质量为 g。
②已知: 和 溶解度曲线如图所示。
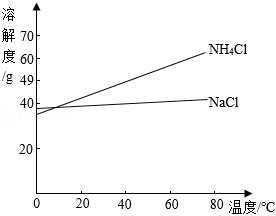
向 溶液中加入 粉末,可使 结晶析出。为使剩余的 和 混合溶液中的 充分结晶析出,应采用的结晶方式是 。
明代《徐光启手迹》中记载了硝酸的制法。
(1)原料 绿矾五斤,硝五斤。
绿矾( )和硝( )均属于 (填序号)。
A.氧化物
B.酸
C.碱
D.盐
(2)预处理 将矾炒去,约折五分之一。二味同研细,听用。
①加热绿矾,质量约减小 。该过程中绿矾失去部分水,生成 。写出反应的化学方程式: 。
②研碎 和 ,研碎的目的是 。
(3)制备 用铁作锅,铁锅置炭炉上,锅下起火…取起冷定,开坛则药化为强水。强水即硝酸,制备时发生如下反应: ; ; 。
①以上三个反应中未涉及的反应类型是 (填“化合”、“分解”、“置换”或“复分解”)反应。
② 和 的水溶液中均含有的阳离子是 (填符号)。
常州人史一安发明的“史氏环氧化反应”是世界有机催化发展史上的重要里程碑。
(1)手性酮是史氏环氧化反应的催化剂。
①史氏环氧化反应前后,手性酮的质量和 均未改变。
②手性酮用天然糖类制备,糖类可由绿色植物通过 作用合成。
(2) 或 是进行史氏环氧化的重要反应物。
① 中硫、氧原子数之比为 。
② 中氢元素的化合价为 。
(3)史氏环氧化反应一般在弱碱性条件下进行。下列pH范围适宜的是 。(填序号)
A.1~2
B.5~6
C.7~8
D.13~14
试题篮
()