高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。
Ⅰ.不稳定性
(1)如图所示进行实验,KMnO 4受热分解的化学方程式为 ,3.16g KMnO 4产生O 2的质量为 g。
(2)用向上排空气法收集O 2的原因是 。
Ⅱ.腐蚀性
[查阅资料]KMnO 4溶液呈中性、有腐蚀性
[进行实验]
实验1:将新鲜鸡皮在不同浓度的KMnO 4溶液中浸泡相同时间,现象如表
| KMnO 4溶液浓度 |
0.002% |
0.01% |
0.1% |
1% |
| 鸡皮的变化 |
无明显变化 |
边缘部分变为棕黄色 |
全部变为棕色 |
全部变为黑色 |
实验2:将铜片分别浸泡在4种浸泡相同时间,现象如下表。
| 编号 |
① |
② |
③ |
④ |
|
| 实验 |
25mL0.1%KMnO 4溶液 |
25mL0.1%KMnO 4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO 4溶液+10滴浓硫酸 |
|
| 铜片 质量/g |
实验前 |
0.54 |
0.54 |
0.54 |
0.54 |
| 18小时后 |
0.54 |
0.52 |
0.54 |
0.43 |
|
| |
|
|
|
|
|
[解释与结论]
(3)实验1的目的是 。
(4)实验2中通过对比②和④,得出的结论是 。
(5)实验2中,欲得出"KMnO 4和硫酸共同作用对铜才有腐蚀性"的结论,需要对比 (填编号) 。
(6)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。
5Cu+2KMnO 4+8H 2SO 4=5CuSO 4+2MnSO 4+K 2SO 4+ 。

兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
| 液体名称 |
蒸馏水 |
碳酸氢钠溶液 |
碳酸钠溶液 |
氢氧化钠溶液 |
| 紫甘蓝汁液显示的颜色 |
蓝紫色 |
蓝色 |
绿色 |
黄色 |
查阅资料:
| pH |
7.5~9 |
10~11.9 |
12~14 |
| 紫甘蓝汁液显示的颜色 |
蓝色 |
绿色 |
黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为 。
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由 色变为 色。向其中加入稀盐酸,该反应的化学方程式为 。
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。a点表示的意义是: 。
【得出结论2】从微观角度分析,该反应的实质是 。
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
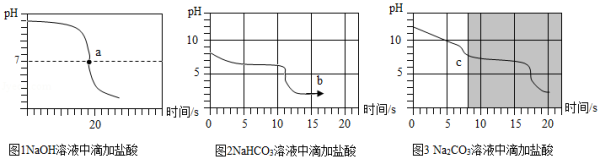
【交流与反思】b点的溶质为 (写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质 (写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示: 、 。
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程。
"氧泡泡"系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na 2CO 3•3H 2O 2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na 2CO 3和H 2O 2,其水溶液具有Na 2CO 3和H 2O 2的双重性质;
Ⅱ.过碳酸钠与盐酸反应:2(2Na 2CO 3•3H 2O 2)+8HCl═8NaCl+4CO 2↑+3O 2↑+10H 2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放处的"活性氧"有关,"活性氧"含量越高,去污能力越强。
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈 (选填"酸性"、"中性"或"碱性")。
(2)向过碳酸钠水溶液中加入少量MnO 2时产生大量气泡,发生反应的化学方程式是 。
(3)过碳酸钠样品中"活性氧"含量可按如下公式计算:
"活性氧"含量=  ×100%
×100%
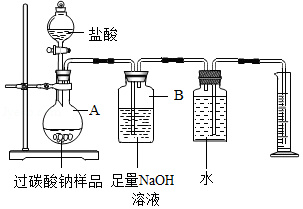
为测定某过碳酸钠样品中"活性氧"含量,取20g样品按如图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与盐酸反应,装置气密性良好)
①将盐酸慢慢地入A中,反应一段时间,观察到 ,停止滴加盐酸。
②装置B可吸收生成的CO 2,该反应的化学方程式是 。
③甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的 。
④将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的"活性氧"含量,写出其计算过程。
⑤完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO 2的质量,据此可计算出样品中"活性氧"含量。但丁同学认为该方案不合理,丁同学的理由是 (填写一条即可)
某项目学习小组进行了如下探究。
【查阅资料】
电导率越大,溶液导电性越强,离子浓度越大。
鸡蛋壳主要成分是CaCO3,其它成分对实验影响忽略不计。
鸡蛋壳与牙齿和含氟牙膏反应的化学原理相似。
【实验一】鸡蛋沉浮
将一个新鲜的鸡蛋放在盛有足量稀盐酸的烧杯中,可观察到鸡蛋一边冒气泡一边沉到底,一会儿又慢慢上浮,到接近液面时又下沉。
(1)冒气泡的原因 (化学方程式表示)。
(2)接近液面时又下沉的原因 。
【实验二】鸡蛋壳溶解
在烧杯中加入蒸馏水,插入电导率传感器,加入蛋壳粉,搅拌,测得电导率随时间的变化如图1。

(3)搅拌的目的是 。
(4)图1中,a﹣b段电导率变化的原因 。b﹣c段电导率基本不变的原因 。
【实验三】鸡蛋壳代替牙齿探究含氟牙膏能否预防龋齿
(5)查资料知,含氟牙膏(含氟成分为NaF)与蛋壳反应在表面生成氟化钙保护层。反应的化学方程式为 。
(6)先检查图2装置气密性,方法是 。再称取0.50g“牙膏处理过的蛋壳(用牙膏浆液浸泡、洗涤、晾干)”于锥形瓶中,用注射器抽取20mL3.5%的盐酸(模拟形成龋齿的酸环境),连接好装置,打开开关,将盐酸快速压人锥形瓶,关闭开关,测得压强随时间的变化如图3所示。用“未用牙膏处理的蛋壳”重复上述实验。

(7)图3中x﹣y段压强增大的主要原因 。
(8)根据实验三的数据分析,含氟牙膏 (填“能”或“不能”)预防龋齿,理由是 。
焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠。某化学兴趣小组对碳酸氢钠的化学性质进行探究:
【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为10.由此得出的结论是碳酸氢钠溶液显 。
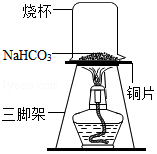
【探究实验二】碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如图所示。
【查阅资料】碳酸氢钠受热易分解,生成水、二氧化碳气体和一种常见的固体物质。
(1)加热一段时间后观察烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到 。
(3)该兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是 。
②请设计实验,检验反应后的固体产物是NaOH或Na2CO3,并完成如表。
限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管。
序号 |
实验操作 |
预期现象 |
结论 |
Ⅰ |
取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,加入足量 氯化钙溶液 ,振荡,静置 |
产生白色沉淀 |
产物含Na2CO3 |
Ⅱ |
取Ⅰ操作后的上层清液于试管B中,滴加酚酞溶液 |
|
产物不含NaOH |
某化学兴趣小组把金属钠放到硫酸铜溶液中,实验并非如想象的有红色铜析出,而是生成一种蓝色沉淀,同学们非常好奇进行实验探究.
(1)【提出问题】金属钠放到硫酸铜溶液中到底发生了怎样的化学反应?
(2)【查阅资料】钠是非常活泼的金属,能与水发生剧烈反应,并放出气体,生成的溶液显碱性
(3)【实验探究】
实验一:把一小块擦干净的金属钠放到装有少量蒸馏水的试管中,点燃生成的气体,听到“噗”的一声后燃烧起来,说明有 气体生成
实验二:在剩余的溶液中滴加硫酸铜溶液,发现有蓝色沉淀
(4)【实验总结】实验一中发生反应的化学方程式是 ;实验二中发生反应的化学方程式是
(5)【实验拓展】兴趣小组又将一小块擦干净的金属钠放入盛有FeCl3溶液的烧杯中,观察到发生了化学反应,该反应的化学方程式是 .
蚊虫叮咬时能在人体皮肤内分泌出蚁酸,让人痛痒不止.某课外兴趣小组在老师的带领下决定对蚁酸进行探究.
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;蚁酸在一定条件下会分解成两种氧化物.
【实验与探究一】
向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显 性.
【实验与探究二】
(1)小明同学根据蚁酸中含有氢元素,推测出生成物中含有水;
(2)另一种生成物是气体,小刚提出两种猜想:
猜想①:该气体是 ;猜想②:该气体是一氧化碳.
为了证明自己的猜想,他们将蚁酸分解产生的气体通过如图所示的装置(铁架台已略去),观察现象.

Ⅰ.实验时装置A中无明显变化,则猜想① (选填“成立”或“不成立”).
Ⅱ.实验时装置C中的实验现象 ,由上述实验现象,得出猜想②成立.
【评价与反思】E处酒精灯的作用是 .
某小组在学习"二氧化碳与氢氧化钠溶液反应"时,进行了如下探究,
【提出问题】二氧化碳与氢氧化钠反应,还是溶解在水中?
【查阅资料】
①15℃、101KPa时,二氧化碳的溶解度如下:
| 溶剂 |
水 |
酒精 |
| 溶解度 |
1.0 |
0.3 |
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
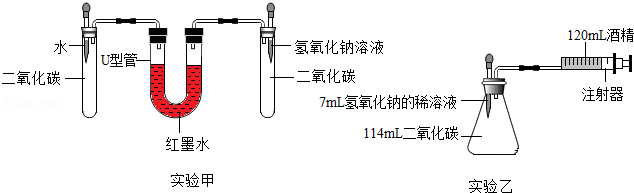
【实验设计】在15℃、101KPa时,制取二氧化碳并用于实验甲、实验乙。
【分析与表达】
(1)如果二氧化碳与氢氧化钠反应,化学方程式是 ,那么氢氧化钠应 保存。
(2)实验前,两套装置都进行气密性检查,实验甲装置气密性检查的方法是
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是
(4)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是 。(填答案字母)
A.先慢后快 B.先快后慢 C.先慢后快,再变慢
实验乙中,还可能观察到的现象是 。
(5)实验乙中,120mL酒精 (填"能"或"不能")换成水,原因是 。
(6)实验乙结束时,注射器中酒精体积为20mL,则与氢氧化钠反应的二氧化碳体积至少是 mL。
(7)由以上探究可知,二氧化碳能溶于水,也能氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有 。(写一条)
对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小组的同学一起探究并回答问题:
【设计与实验】
实验 序号 |
实验步骤一 |
实验步骤二 |
实验 序号 |
实验步骤一 |
实验步骤二 |
实验I |
|
|
实验II |
|
|
【探究与结论】
(1)实验I中步骤一看不到明显现象,步骤二产生的现象是 。
(2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式是 。
(3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是 。
【拓展延伸】现有下列信息:

请你和化学兴趣小组的同学一起利用以上资料信息再设计实验Ⅲ,证明CO2确实与NaOH发生了化学反应。
实验Ⅲ的操作为: 。
看到的现象是 。
化学兴趣小组的同学在探究碱的化学性质时,完成了如图1所示的两个实验。实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色。请你完成下列问题:
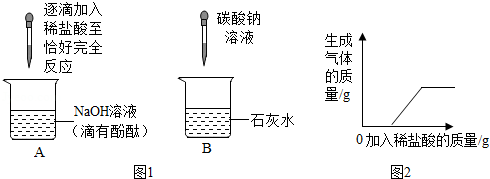
(1)A实验中发生反应的现象为 。
(2)B实验中发生反应的化学方程式是 。
(3)【提出问题】废液中,能使酚酞溶液变红的物质可能是哪些呢?
【作出猜想】猜想一:废液中,能使酚酞溶液变红的物质可能是NaOH;
猜想二:废液中,能使酚酞试液变红的物质还可能是 ;
猜想三:废液中,能使酚酞溶液变红的物质还可能是Ca(OH)2。
【实验验证】同学们对可能含有的碱性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到如图2所示的图象。
【结论】分析图象数据得出,废液中使酚酞变红的物质一定是 ,一定不是 。
【拓展提高】为了使以上废液实现安全排放,你的做法是 。
加热碳酸氢铵时闻到了刺激性气味,引起了同学们对氨气的兴趣,决定对其进行探究。
(一)探究性质与变化
【实验方案】如图所示
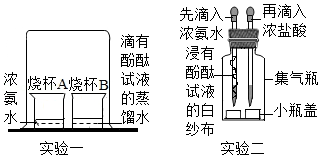
【实验现象】
(1)实验一中的现象是 。
(2)实验二中先滴入浓氨水,一段时间后,再滴入浓盐酸。滴入浓盐酸后观察到的现象是:①集气瓶中从下至上出现白烟,② (写一点)。
【实验结论】
(3)微观上,说明微粒具有的性质是 。宏观上,从物质的性质或变化的角度分析,你得出的结论是 (写一点)。
【反思与评价】
(4)实验二避免了实验一的不足,改进后的优点有 (写一点)。
(二)验证氨气中氮、氢两种元素的质量比
【查阅资料】
(5)氨气在加热条件下能与氧化铜反应:2NH3+3CuO 3X+N2+3H2O,X的化学式是 。
3X+N2+3H2O,X的化学式是 。
【设计方案】如图所示:(假定氮气被完全吸收)

【数据处理与误差分析】
充分反应后,测得A、B、C三个装置在反应前后的质量变化如下表所示
装置 |
A |
B |
C |
数据 |
减少了4.8g |
增加了6.0g |
增加了2.8g |
(6)甲同学利用A、B、C三组装置所提供的数据,乙同学利用B、C两组装置所提供的数据,计算出的氮、氢元素的质量比都与理论值明显不符,分析产生误差的原因是 。
(7)若用A、C两组装置所提供的数据计算,与理论值是否相符?写出简单的计算过程证明你的结论 。
(三)探究用途与制法
(8)在一定条件下,可用氮气和氢气制得氨气。工业上常用氨气生产氮肥(NH4)2SO4,施肥时,要避免与之混用的是 (填序号)。
A.硝酸钾 B.草木灰(主要成分是K2CO3)
C.熟石灰 D.氯化钾
(9)工业上生产的(NH4)2SO4中常常混有少量KCl,检验其是否含有KCl的操作方法是 。
附:部分碱、酸、盐的溶解性表(20℃)
阴离子/阳离子 |
OH﹣ |
NO3﹣ |
Cl﹣ |
SO42﹣ |
H+ |
溶、挥 |
溶、挥 |
溶 |
|
K+ |
溶 |
溶 |
溶 |
溶 |
NH4+ |
溶、挥 |
溶 |
溶 |
溶 |
Ba2+ |
溶 |
溶 |
溶 |
不 |
Ag+ |
﹣ |
溶 |
不 |
微 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“﹣”表示那种物质不存在或遇到水就分解了。
试题篮
()