小倩同学了解到:外国人把中国称为"China",在英文中与瓷器是同一个单词。"青花瓷"又是在中国瓷器中最具代表性的。绘制青花瓷纹饰的原料中主要含有氧化钴(CoO)。
她查阅元素周期表发现钴[读音:gǔ]元素符号为Co,在周期表中与铁元素同位于第4周期、第Ⅷ族。

【提出问题】
小倩同学产生疑问:为什么钴和铁都在第Ⅷ族呢?
【寻求帮助】
(1)[咨询老师]得知:因为铁与钴两种元素原子的结构具有相同点(见图2),使得二者的化学性质相似。因此把这两种元素放在一起。
请你帮助小倩完成下列问题:
①钴元素在元素周期表中的原子序数为 ;一个钴原子比一个铁原子多一个 (填序号)。
A.中子 B.电子 C.质子 D.电子层
②铁原子与钴原子具有相同的 (填序号,下同)。元素的化学性质主要与原子的 有关,因此二者的化学性质相似。
A.核电荷数 B.核外电子数 C.电子层数 D.最外层电子数
③在化学反应中,金属钴和铁一样,也能与稀盐酸发生反应放出氢气,反应的化学方程式为 ;钴在氧气中燃烧生成Co 3O 4,化学方程式为 。
(2)[查阅资料]钴元素有着广泛的用途:钴及其化合物在材料生产、化工生产、医疗中都有着广泛的应用。钴在电池制造中需求量增长很快,钴酸锂(已知:化学式为LiCoO 2,锂元素化合价为+1)常用作手机电池的正极材料,其中钴元素的化合价为 。
【深入探讨】
[产生问题]既然钴与铁的单质具有相似的性质,那么两种元素的化合物是否也有相似的化学性质?
[设计并实验验证]
(1)根据所学知识,同学们已知下列反应可以进行,并进行实验:
FeO FeCl 2 Fe(OH) 2
观察记录实验现象:氧化亚铁为黑色固体;实验a中,随着稀盐酸的加入,黑色固体逐渐溶解,溶液呈现浅绿色;实验b中,加入氢氧化钠溶液后出现白色沉淀,静置在空气中,沉淀物颜色发生变化,最后变为红褐色。[查阅资料得知:原因是溶液中的Fe(OH) 2遇空气中的氧气生成Fe(OH) 3]
(2)同学们欲探究钴元素化合物的性质。设计并进行了如下实验:
CoO CoCl 2 Co(OH) 2
请你依据实验现象,完成下列问题:
Ⅰ.实验①中,取少量灰黑色的氧化钴放入试管中,加入稀盐酸,固体被溶解,溶液呈红色,写出反应的化学方程式 。另取一支试管加入少量氧化钴,滴入浓盐酸,固体被溶解,溶液呈绿色。说明反应后钴离子在溶液中呈现的颜色与加入酸的 有关。
Ⅱ.实验②中,加入氢氧化钠溶液,出现青蓝色沉淀。将试管静置在空气中,沉淀物颜色发生变化,最终变为棕色,试推测沉淀物颜色变化可能与空气中的 有关。
通过实验探究,同学们得出结论:铁和钴两种元素的化合物化学性质相似。
在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.

(1)【推断】观察到D中黑色固体变红,则B中生成的气体是 .
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe 2O 3是红棕色,其余均为黑色,只有Fe 3O 4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe 3O 4
猜想二:剩余固体是
【实验探究】
| 实验操作 |
实验现象及结论 |
【实验结论】铁与水蒸气反应的化学方程式为
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe 2O 3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为 .
学习了酸、碱、盐的相关知识后,某兴趣小组同学在老师的指导下开展了以下探究活动。
实验一:验证酸、碱、盐之间能发生化学反应。
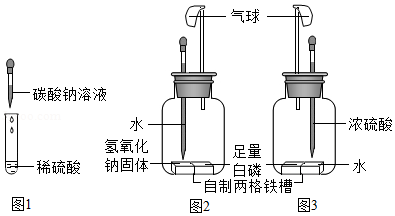
【进行实验】为了验证硫酸与碳酸钠能发生化学反应,小明做了如图1所示实验,观察到试管中的现象为 ,则证明两种物质发生了化学反应,该反应的化学方程式为 。
【设计实验】为了验证硫酸与氢氧化钠能发生化学反应,小刚设计了如下实验方案。
实验操作 |
预期实验现象 |
实验结论 |
步骤一:将氢氧化钠溶液滴入稀硫酸中并振荡 |
溶液呈无色 |
硫酸与氢氧化钠能发生化学反应 |
步骤二:向步骤一所得无色溶液中滴加几滴酚酞溶液 |
溶液呈无色 |
请你评价小刚设计的实验方案是否可行,并说明理由 。
【反思提高】证明无色溶液之间能发生化学反应的方法有很多,请你举出一个通过生成沉淀来证明发生化学反应的实例 (只要求写出两种反应物)。
实验二:利用酸、碱溶于水放热的性质探究燃烧条件。
【进行实验】如图2所示,实验过程中,观察到滴水之前白磷不燃烧,滴水之后白磷燃烧。由此可推出可燃物燃烧需要的条件之一是 。写出白磷燃烧的化学方程式 。
【拓展延伸】有同学想利用图2装置,并且将部分药品进行更换(如图3所示),也来探究燃烧条件,你认为此实验方案是否可行并说明理由 。
某校化学兴趣小组将Cu块加入到盛稀H 2SO 4溶液的试管中,Cu块不溶解,不发生化学反应。再向此试管中加入KNO 3溶液,发现Cu块逐渐溶解,有无色气体产生,该气体与空气接触后变成红棕色的气体,最后Cu块完全溶解,变成蓝色溶液。
【提出问题】Cu块与什么物质发生了化学反应,产生的气体是H 2吗?
小军同学认为产生的气体一定不是H 2,你认为他作出此判断的合理理由是 。
【查阅资料】他们通过查阅资料知道:NO是一种无色气体,与空气接触后生成红棕色的NO 2气体。请写出此气体颜色发生变化的化学方程式 。
【提出猜想】
猜想一:Cu块与KNO 3溶液发生了化学反应;
猜想二:Cu块与K 2SO 4溶液发生了化学反应;
猜想三:Cu块与 溶液发生了化学反应。
【设计实验】
| 实验步骤 |
实验现象 |
解释或结论 |
| ①将Cu块加入KNO 3溶液中。 |
Cu块不溶解 |
说明猜想一是错误的 |
| ②将Cu块加入到 溶液中 |
Cu块不溶解 |
说明猜想二是错误的 |
| ③将Cu块加入到稀HNO 3溶液中 |
Cu块溶解,有无色气体产生,该气体与空气接触后变成红棕色的气体,溶液变成蓝色 |
说明猜想三是正确的 |
【实验结论】猜想三成立。请写出Cu块加入到稀HNO 3溶液中发生反应的化学方程式 。
【讨论交流】实验结束后,同学们在一起进行交流。从复分解反应的角度分析,H 2SO 4和KNO 3 (填"能"或"不能")发生化学反应。Cu块是如何与稀HNO 3溶液发生化学反应的呢?他们带着这个问题去请教老师,老师告诉他们:H 2SO 4溶液解离出H +和SO 4 2 ﹣,KNO 3溶液解离出 ,可以间接地看成有HNO 3溶液。老师还告诉大家:Ag也能与稀HNO 3溶液反应。请写出将Ag粉加入到HCl和NaNO 3混合溶液中所产生的实验现象 。
某兴趣小组制取气体并进行探究活动。
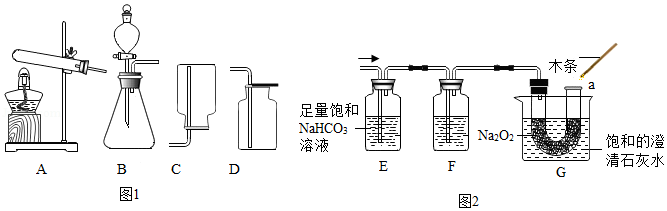
(1)如图1为实验室制备气体的常用装置。实验室用高锰酸钾制取并收集氧气,应选用的装置是 (填字母),反应的化学方程式为 。实验室制取二氧化碳应选用的发生装置是 (填字母)。
(2)二氧化碳的用途之一是灭火,但当钠燃烧时,二氧化碳不仅不能灭火,反而会使燃烧更加剧烈。
【查阅资料】钠燃烧会生成过氧化钠(Na2O2),过氧化钠是一种淡黄色固体,常温下与二氧化碳或水都能发生反应。
【提出题】为什么燃烧会更加剧烈?二氧化碳和过氧化钠反应生成了什么物质?
【实验探究】将上述二氧化碳发生装置与如图2装置(气密性良好)连接。制备二氧化碳,过一段时间后,G烧杯中澄清石灰水变浑浊,a处带火星的小木条复燃。
【实验分析】
①装置E的作用是除去CO2中的HCl气体,装置F的作用是 。
②G烧杯中澄清石灰水变浑浊的原因是 。
【实验结论】二氧化碳和过氧化钠反应生成氧气能使燃烧更加剧烈。结合所学知识得出CO2与Na2O2反应的生成物为 (填字母)。
a,Na2O和O2 b.NaOH和O2 c.Na2CO3和O2 d.NaHCO3和O2
【总结提高】二氧化碳可用于灭火,但不是所有可燃物失火都可以用二氧化碳来扑灭。
实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣.
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu 2(OH) 2CO 3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO 2反应生成碳酸钠固体和水
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中.
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成.
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分.
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物.
【设计方案】请帮助该同学完成下述实验报告:
| 实验操作与现象 |
实验结论 |
|
|
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO 2和H 2O.
【进行实验】选择如下图所示装置进行验证
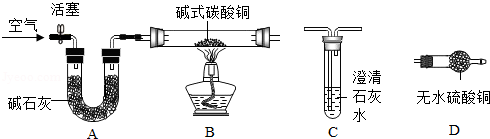
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填"C","D");
步骤三:点燃酒精灯,观察到明显现象后,停止加热
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO 2和H 2O,写出装置C中反应的化学方程式 ;
②写出Cu 2(OH) 2CO 3受热分解的化学方程式 .
【反思与评价】
上述装置中A的作用是 .
某化学兴趣小组用如图装置验证一氧化碳还原氧化铜,并探究其还原产物的组成.

(1)装置及反应原理探究
①B装置中浓硫酸的作用为 .
②说明CO能还原CuO的现象为 .
③上述整套装置中发生的化学反应,其中属于化合反应的化学方程式 .(不考虑CO 2和H 2O的反应.)
(2)产物成分探究
【查阅资料】Ⅰ、一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu 2O)
Ⅱ、Cu 2O为不溶于水的红色固体
Ⅲ、Cu 2O+H 2SO 4═Cu SO 4+Cu+H 2O
【提出问题】红色固体含有什么物质?
【猜想假设】假设一:红色固体只含Cu
假设二:红色固体只含Cu 2O
假设三: .
【实验验证】该小组为验证上述假设,取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解.
【实验结论】根据上述实验结果,可知红色固体中一定含有 .
【数据处理】为进一步确定红色固体的成分,甲、乙两同学分别称取各自实验后的一定质量的红色固体,加到足量稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体质量如表,请完善表中内容.
| 实验人员 |
红色固体(g) |
剩余红色固体(g) |
实验结论 |
| 甲 |
7.2 |
3.2 |
|
| 乙 |
4.08 |
2.48 |
|
【交流与反思】只要假设合理,方法正确,根据实验现象和数据就能得出结论.
小嘉用H2O2溶液制取氧气时,在烧瓶中加入50毫升水及0.5克MnO2,再往分液漏斗中加入30毫升15%的H2O2溶液。为什么要加入50毫升水呢?查阅资料发现:在不加入水时,若注入H2O2溶液速度过快,反应会过于剧烈而引发事故。
【提出问题】水是如何减缓该反应速度的呢?
【建立假设】水可以降低H2O2溶液浓度,从而减缓反应速度。
【实验方案】他利用如图装置,在相同条件下,分别用30毫升的1%、3%和7%的H2O2溶液进行实验,观察并比较。
【实验结论】加水降低了H2O2溶液的浓度,使反应速度变慢。
【交流反思】
(1)为了更好地比较反应的快慢,需控制三次实验中滴加H2O2溶液的 相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较 。
【继续探究】针对提出的问题,他又利用如图装置,用3%的H2O2溶液分别在0℃、20℃和60℃的条件下进行实验。进行该实验所基于的假设是 。

(1)除探究要素不同之外,其它条件都应该是相同的,在相同条件下,分别用30毫升的1%、3%和7%的H2O2溶液进行实验,为了更好地比较反应的快慢,需控制三次实验中滴加H2O2溶液的速度相同。
(2)图中实验,用量筒收集生成的氧气,判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较相同时间内收集到氧气的体积。
(3)利用如图装置,用3%的H2O2溶液分别在0℃、20℃和60℃的条件下进行实验,控制的变量是温度不同,进行该实验所基于的假设是水可以降低温度,减缓反应的速率。
故答案为:
茶垢清洁剂能快速清除茶具上附着的茶垢,某小组同学对茶垢清洁剂进行了探究。
【查阅资料】如图1所示是某品牌茶垢清洁剂说明书中的部分内容。说明书中碳酸钠的俗称有误,应改为 。
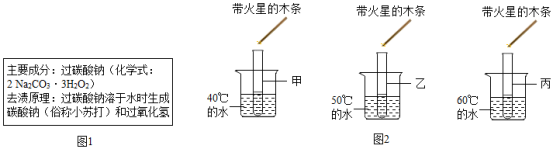
【提出问题Ⅰ】茶垢清洁剂溶于水时生成过氧化氢,是否生成氧气?
【实验1】在盛有茶垢清洁剂固体的小烧杯中,加适量常温水,完全溶解后得到无色溶液,观察到有小气泡缓慢冒出,伸入带火星的木条,木条不复燃。
【实验2】取三份等量的实验1中的溶液,分别加入甲、乙、丙三支试管中,按图2所示进行实验。观察到都较快产生气泡,且温度越高产生气泡越快;伸入带火星的木条,木条都复燃。
【表达交流Ⅰ】通过实验证明,茶垢清洁剂溶于水时生成氧气。
(1)实验1中"木条不复燃"的原因是 。
(2)实验2中丙试管内不再产生气泡后,其中溶液所含溶质与加热前溶液的不同是 。
【提出问题Ⅱ】茶垢清洁剂溶于水时生成碳酸钠,是否生成氢氧化钠?
【实验3】取实验2丙试管内溶液,按如图3流程进行实验。
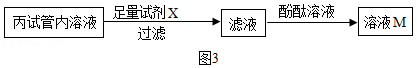
【表达交流Ⅱ】
(1)加入试剂X的目的是 (用化学方程式表示)。
(2)不新增试剂,检验加入的试剂X已足量的方法是 。
(3)溶液M呈 色,说明茶垢清洁剂溶于水时没有生成氢氧化钠。
【反思总结】
(1)茶垢清洁剂溶于水生成了碳酸钠和过氧化氢。碳酸钠溶液有较好的去污效果,过氧化氢分解生成活性氧,可深层带走污垢。
(2)使用茶垢清洁剂时应选择 的水进行溶解,去垢效果更好。
央视频道《是真的吗?》栏目中有一段视频:将"锡纸"剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到"锡纸"立即燃烧.据此,小晟同学取某种"锡纸"进行了探究:
(1)"锡纸"燃烧的原因:"锡纸"两端接入电池两极后造成短路致使"锡纸"燃烧,从燃烧的条件分析:开始"锡纸"不燃烧但短路后却能燃烧的原因是 (填"与氧气接触"或"温度达到着火点").
(2)探究"锡纸"中金属的成分:"锡纸"中的金属是锡吗?
【查阅资料】①"锡纸"是锡箔或铝箔和纸粘合而成;
②锌粉是一种深灰色固体
③锡(Sn)与酸或盐溶液反应生成+2价的锡盐
【提出猜想】猜想Ⅰ:"锡纸"中的金属是锡; 猜想Ⅱ:"锡纸"中的金属是铝;
【进行实验】设计方案并进行实验
| 实验操作 |
实验现象 |
实验分析与结论 |
| 取打磨后的"锡纸"片放入试管中,滴加氯化锌溶液 |
"锡纸"表面有深灰色固体析出 |
根据实验现象,结合金属活动性顺序 可知猜想 (填"Ⅰ"或"Ⅱ") 成立;反应的化学方程式为 . |
【交流讨论】①实验中打磨"锡纸"的目的是 ;
②下列物质的溶液可以替代氯化锌溶液完成上述实验的是 (填序号).
A.氯化铜 B.硝酸银 C.硫酸钠 D.硫酸亚铁
【拓展应用】电器短路会引起火灾,我们要严加防范.如果电器着火应该采取的灭火方法是 .
某初中化学兴趣小组的四位同学。往氢氧化钠溶液中滴加酚酞溶液时。发现溶液变成了红色,可是过了一会儿,红色就消失了,溶液恢复为无色,溶液的红色为什么会变成无色呢?他们对这一现象进行了探究,请你和他们一起完成下边的探究历程。
【提出猜想】
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气发生反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
【理论分析】
(1)对于甲同学的猜想,你认为 ( 填“合理”或“不合理”).请写出你的理由: 。
(2)对于乙同学的猜想,大家认为是不正确的,因为氢氧化钠溶液虽然与空气中的二氧化碳反应,生成碳酸钠和水,但碳酸钠水溶液显碱性,由于溶液中有自由移动的 (写离子符号),所以红色不会消失。
【查阅资料】为了排除是酚酞溶液导致的原因,同学们决定重新配制酚酞溶液进行试验,他们在网络上查阅了资料,百度百科中对酚酞的描述如下表。
中文名 |
酚酞 |
结构式 |
|
外观 |
白色至微黄色结晶性粉末 |
||
常温下溶解性 |
<0.1g/100mL(水中) >5g/100mL(乙醇中) |
||
化学式 |
C20H14O4 |
(3)由上表可知,配制酚酞溶液的溶剂是 (选填“水”或“乙醇”).在检测溶液剂酸碱性的实验中,往待测溶液中滴入1﹣﹣2滴酚酞溶液即可,滴入过多的酚酞有可能出现白色沉淀的现象,该现象产生的原因是 。
【实验验证】
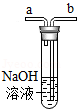
(4)如图,为了验证丙同学的猜想,四位同学在一支密封的装有NaOH 溶液的试管中,先通入密度比空气大的稀有气体,将试管内的空气排尽,随后注入新配制的酚酞溶液,观察到的现象依然是溶液先变成红色,过了一会儿红色消失,如图稀有气体应由导管口 (选填“a”或“b”)处通入。
(5)若丁同学的猜想正确,请你完成下列实验设计
实验方法 |
实验现象和结论 |
|
|
【应用拓展】
(6)从查阅百度百科资料知道,酚酞(H2In表示)其实是一种极弱的酸,其遇碱变红的变化表达式为:
H2In  In2﹣(红色)
In2﹣(红色)
根据上述信息,请写出H2In遇NaOH溶液变红的化学方程式: 。
某化学兴趣小组同学学习海水"制碱"知识后,到实验室做实验,小华实验:先取2mL Na 2CO 3溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;小红实验:先取2mL稀盐酸于试管中,再用胶头滴管滴入少量Na 2CO 3溶液,却马上观察到有气泡产生,两人实验所用的Na 2CO 3溶液、稀盐酸均相同,却观察到不同的实验现象,他们为了查明原因,查阅资料:
①HCl和Na 2CO 3反应时其实是分步进行的,即:
Na 2CO 3+HCl═NaCl+NaHCO 3(先),NaHCO 3+HCl═NaCl+H 2O+CO 2↑(后)。
②NaHCO 3溶液与足量澄清石灰水混合会变浑浊。
③Ca(HCO 3) 2溶于水
请回答:(1)NaHCO 3俗称 ;
(2)NaHCO 3在医疗上是治疗 的药剂之一。
【提出问题】小华实验后溶液中的溶质是什么?
【猜想与假设】猜想①NaCl;②NaCl、NaHCO 3;③NaCl、Na 2CO 3;④NaCl、Na 2CO 3、NaHCO 3
【提出质疑】小红认为猜想 一定不正确。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| 取适量小华实验后的溶液于试管中,滴入澄清石灰水 |
溶液变浑浊 |
猜想④成立 |
【交流与反思】(1)大家一致认为上面实验探究结论不正确,原因是 (用化学方程式表示)。
(2)小红认为,小华实验后的溶液应该继续慢慢滴入稀盐酸,若一开始无明显现象,一会后观察到有气泡产生,则猜想 成立。
【归纳与总结】小华实验与小红实验现象不同的主要原因与 有关。
如图是两个实验小组分别进行"加热硫酸铜和氢氧化钠溶液反应后生成物"的实验过程示意图:

【甲组】氢氧化钠与硫酸铜反应的化学方程式为 ,加热后产生黑色的氧化铜.
【乙组】为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
6NaOH+4CuSO 4═3Na 2SO 4+Cu 4(OH) 6SO 4↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解.
【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性; 猜想Ⅱ:生成的硫酸钠使溶液呈酸性.
【实验与结论】
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH (填">"、"<"或"﹦"),硫酸铜溶液呈酸性,猜想Ⅰ成立.
实验②:向盛有硫酸钠溶液的试管中逐滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈 (填"酸"、"中"或"碱")性,猜想Ⅱ不成立.
【交流和反思】(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是 ;
(2) 在化学反应中, 相同的反应物因质量比不同可能会导致生成物不同, 请另举一列 (写出反应物即可).
某化学兴趣小组在实验室探究碳酸钠溶液与稀盐酸的反应原理,请你一起完成实验探究。
实验一:在5mL稀盐酸中逐滴加入碳酸钠溶液,边滴边振荡,直至滴完5mL碳酸钠溶液。
现象:开始有气泡产生,一段时间后无气泡产生。写出碳酸钠与稀盐酸反应的化学方程式 。在反应后的溶液中加入2滴酚酞溶液,溶液变红,则反应后溶液中的溶质是 。
实验二:在5mL碳酸钠溶液中逐滴加入稀盐酸,边滴边振荡,直至滴完5mL稀盐酸。
现象:整个实验过程无气泡产生。
【提出问题】用量相同的两种反应物,滴加顺序不同,现象为什么不一样呢?
【查阅资料】碳酸钠溶液与盐酸反应:
1.盐酸过量时,反应生成NaCl、CO 2和H 2O;
2.盐酸不足时,产物是NaCl和NaHCO 3。
【假设猜想】实验二结束后,试管中溶液的溶质有哪些?
猜想1:NaCl、Na 2CO 3和NaHCO 3
猜想2:
猜想3:NaCl
猜想4:NaCl和HCl
小明认为猜想3和4明显不合理,理由是 。
【实验探究】实验二结束后,将试管中溶液分成三等份,分别做下列三个实验。
| 序号 |
实验操作及实验现象 |
实验结论 |
| 实验1 |
加入硝酸银溶液,产生白色沉淀 再加入稀硝酸溶液,沉淀不消失 |
溶液中含 (写离子符号) |
| 实验2 |
加入 溶液,无沉淀产生 |
猜想1不成立 |
| 实验3 |
加入 溶液,有 产生。 |
猜想2成立 |
【交流反思】用量相同的两种反应物,滴加顺序不同,现象和产物可能都不一样。
如图是两个实验小组分别进行"加热硫酸铜和氢氧化钠溶液反应后生成物"的实验过程示意图:

【甲组】氢氧化钠与硫酸铜反应的化学方程式为 ,加热后产生黑色的氧化铜。
【乙组】为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
6NaOH+4CuSO 4═3Na 2SO 4+Cu 4(OH) 6SO 4↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性;
猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
【实验与结论】
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH 7(填">"、"<"或"="),硫酸铜溶液呈酸性,猜想Ⅰ成立。
实验②:向盛有硫酸钠溶液的试管中逐滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈 (填"酸"、"中"或"碱")性,猜想Ⅱ不成立。
【交流和反思】(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是 氢氧化钠与硫酸铜反应会生成蓝白色沉淀;
(2) 在化学反应中, 相同的反应物因质量比不同可能会导致生成物不同, 请另举一列 (写出反应物即可)。
试题篮
()