利用如图所示装置进行如下实验探究。
在锥形瓶中放入一小粒白磷,塞好瓶塞后玻璃管下端刚好能与白磷接触,将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是 。
(2)根据白磷引燃前后的变化,可知燃烧的条件是 ;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是 。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针 (填"向左偏""向右偏"或"指向中间")
(4)白磷(P 4)燃烧生成P 2O 5,写出该反应的化学方程式: 。

某校同学开展以“燃烧的条件”为主题的探究实验活动,请你作为成员一起来完成下列过程。(说明:进行小组实验时,每组用到的仪器自行选择)
【实验准备】烧杯、镊子、坩埚钳、酒精灯、三脚架、水槽等
【实验过程】
组别 |
实验用品 |
实验操作 |
实验现象 |
实验结论 |
A |
相同大小的棉花团、酒精 |
用棉花团分别蘸酒精和水,放到酒精格灯火焰上 |
1.加热片刻, |
I |
2.加热较长时间后两棉花团都燃烧起来 |
Ⅱ |
|||
B |
相同大小的滤纸和乒乓球的碎 片、薄铜片 |
把滤纸和乒乓球的碎片分开放在薄铜片的两侧,放在三脚架上加热铜片的中部 |
一侧的碎片先燃烧,一段时间后另一侧的碎片也燃烧起来 |
与A组中结论 相同(填“I““Ⅱ“) |
C |
蜡烛 |
|
一支熄灭,一支继续燃烧 |
燃烧需要有氧气(或空气) |
【交流讨论】同学们通过讨论,正确解释了得出A组结论I的原因: 。
【反思提升】从安全角度考虑应注意避免因操作不当引起的烫伤烧伤等危险;从知识角度考虑有利于灭火原理的学习。
某实验小组利用如图装置进行“燃烧条件的实验探究”。回答下列问题:

(1)实验前,检验装置A气密性的操作为 ;装置A中发生反应的化学方程式为 。
(2)实验1:将U形管放在盛有80℃热水的烧杯中,关闭K2、打开K1,从U形管左端管口鼓入O2.现象:右端裹有白磷的棉花先冒白烟,片刻后开始燃烧,另一端的普通棉花没有变化。实验1可以得出的燃烧条件为 。
(3)实验2:在上述实验1燃烧过程中,关闭K1、打开K2,从U形管左端管口鼓入气体Y.现象:燃烧着的棉花团很快熄灭,停止燃烧:继续鼓入气体Y,装置C中澄清石灰水变浑浊。写出C中反应的化学方程式 ;装置D中注射器内盛放的试剂X可能为 。
(4)实验3:关闭K2、打开K1,再次鼓入O2,发现右端剩余的裹有白磷的棉花又能燃烧。对比实验2和3,可以得出的燃烧条件为 ;实验2同时能证明气体Y的性质为 ,利用该性质可用于 。
(5)该实验的优点为 。
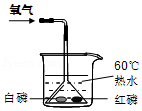
火的利用推动了人类文明的进程,如图是某同学探究可燃物燃烧条件的实验装置。请根据实验现象回答下列问题。
(1)①处白磷燃烧③处红磷不燃烧,原因是 ;
(2)根据②处白磷不燃烧的原理,写出一个灭火的实例: 。

利用如图所示装置进行如下实验探究。
在锥形瓶中放入一小粒白磷,塞好瓶塞后玻璃管下端刚好能与白磷接触,将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是 。
(2)根据白磷引燃前后的变化,可知燃烧的条件是 ;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是 。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针 (填“向左偏”“向右偏”或“指向中间”)
425,写出该反应的化学方程式: P4+5O2 2P2O5 。
2P2O5 。

下面是初中化学中常见的几个基本实验。请回答下列问题。
(1)图A实验中,红磷必须足量的原因是 。
(2)图B实验中可观察到的现象是 。
(3)图C实验是配制氯化钠溶液过程中量取水的操作,该操作将导致所配制的溶液溶质质量分数 (填“偏大”或“偏小”)
(4)图D实验中玻璃棒的作用是 。
(5)图E操作中得到的滤液仍浑浊,其原因可能是 (写一条即可)。
(6)图F实验中,加热片刻后,可观察到棉球上的酒精燃烧而水不燃烧,由此可得出燃烧条件之一是 。
“对比实验”是科学探究常用的方法。根据以下实验回答问题。

(1)图A中,可观察到 (填火焰的名称)处的火柴炭化最明显。
(2)图B中 (填“左”或“右”)边试管发烫。
(3)从图C中可得出燃烧的条件之一是 ,发生反应的化学方程式为 。
(4)图D中打开可乐的瓶塞,可观察到大量气泡冒出,说明气体的溶解度与 有关。
用如图所示装置探究燃烧的条件,有关该实验的说法正确的是( )

A.该实验使用了相同的可燃物
B.该实验只能得出燃烧需要氧气这一结论
C.该实验的现象是铜片上的白磷不燃烧,红磷燃烧
D.该实验说明燃烧需要使温度达到可燃物的着火点
实验是进行科学探究的主要方法。如图A~H是初中化学常见的实验装置,请回答:
【查阅资料】常温下,CO2难溶于饱和NaHCO3溶液。
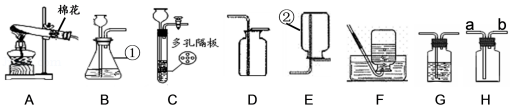
(1)写出仪器名称:① ② ;
(2)写出用装置A制取氧气的化学方程式 ;用双氧水和二氧化锰制取氧气时,选择的发生装置和收集装置的组合是 (写出一种组合即可,填序号);实验室制取氧气时,选择的药品在组成上的共同点是 ;将制得的氧气通入图中,发现只有白磷燃烧,说明燃烧需要满足的条件是 。
(3)实验室用大理石和稀盐酸制取二氧化碳,既可以选用装置B又可选用装置C,相对于装置B,装置C的突出优点是 ;若用装置H收集二氧化碳时,气体应该从 (选填“a”或“b”)端通入;若用装置G除去生成气体中混有的氯化氢气体,则装置G中应盛放 。
下列说法正确的是( )

A.硬水经蒸馏处理后可变为软水
B.长期放置后不会分层的液体一定是溶液
C.图中红磷不燃烧,说明红磷不是可燃物
D.在化学反应中只有燃烧反应才能放出热量
为探究燃烧的条件,某同学进行如图所示的实验:
(1)实验Ⅰ能验证可燃物燃烧需要氧气的现象是 ,反应的化学方程式是 。
(2)设计实验Ⅱ的目的是 。
(3)铜片上的红磷没有燃烧的原因是 。
(4)实验中水的作用是 。

用如图所示实验探究燃烧的条件,下列说法正确的是( )
| ① |
② |
③ |
④ |
| |
|
|
|
| 白磷不燃烧 |
白磷不燃烧 |
白磷不燃烧 |
白磷燃烧 |
| A. |
对比①③说明燃烧的条件之一是可燃物接触氧气 |
| B. |
对比①④说明燃烧的条件之一是需要有可燃物 |
| C. |
对比③④说明燃烧的条件之一是达到可燃物的着火点 |
| D. |
本实验用盘成螺旋状的细铁丝替代白磷,能得到相同的实验结论 |
掌握科学的研究方法,探索化学世界的奥秘。
(1)实验是学习化学的重要途径,对比法是一种常用的实验方法。请完成下列实验中的问题:
实验一:探究燃烧的条件

如图所示,为证明燃烧需要可燃物,可用玻璃棒分别蘸取蒸馏水和 ,置于酒精灯火焰上,观察现象。
实验二:探究铁锈蚀的条件

①试管 (填字母)中的铁钉生锈。
②通过对比试管B、C中的现象,可以得出铁生锈需要与 接触。
(2)在"宏观一微观一符号"之间建立联系,是学习化学特有的思维方式。一氧化碳燃烧的微观模拟示意图如图所示:

依据图中所给信息,回答下列问题:
①写出该反应的化学方程式: ,其基本反应类型是 。
②从微观角度分析
a.CO和CO 2的组成元素相同,但化学性质不同,其原因是 。
b.化学反应前后 不变(写一点)。
(3)比较与归纳是学习化学的重要方法。由碳、氢元素组成的物质种类繁多,烷烃就是其中一类重要的物质,下表列出了烷烃的一些信息。
| 名称 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
己烷 |
…… |
| 化学式 |
CH 4 |
C 2H 6 |
C 3H 8 |
C 4H 10 |
C 5H 12 |
C 6H 14 |
…… |
| 碳元素的质量分数 |
75.0% |
80.0% |
81.8% |
82.8% |
83.3% |
83.7% |
…… |
| 1g物质完全燃烧消耗氧气的质量/g |
4.00 |
3.73 |
3.64 |
3.59 |
3.56 |
3.53 |
…… |
分析表中数据,我们可以总结出一些与烷烃相关的变化规律,写出其中的两条:
①随着烷烃分子中碳原子数的增加,碳元素的质量分数逐渐 (填"增大"或"减小")。
② 。
“对比实验”是科学探究的重要方法,根据下列所示的实验示意图回答问题。
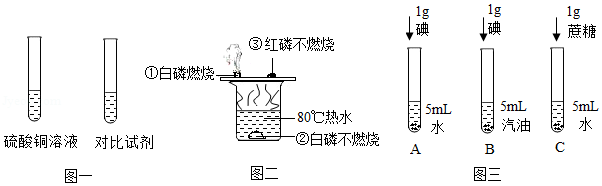
(1)硫酸铜溶液呈蓝色,为探究哪种粒子使溶液显蓝色,可选择用作对比的试剂是 溶液。
(2)如图二,现象①②说明物质燃烧需要与 (填名称)接触,实验中发生了异常,白磷燃烧时有火星飞溅到红磷上,引起红磷燃烧,证明了燃烧的另一个条件是 。
(3)①如图三,同学们做了试管A、B的对比实验,发现试管A中固体几乎不溶,试管B中固体全部溶解,该实验说明了影响物质溶解性的因素是 。
②同学们又补充了试管C所示实验,他们想探究的影响物质溶解性的因素是 。
某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
[实验一](已知:白磷的着火点为40℃)
实验装置 |
实验步骤及现象 |
|
步骤Ⅰ.检验装置的气密性,气密性良好。 步骤Ⅱ.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧。 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。 |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2,如果观察到 ,说明空气中氧气的体积约占 .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于 ,原因可能是 (答一条即可)。
,原因可能是 (答一条即可)。
[实验二]用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量。若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由 。[已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿。化学方程式:2Cu+O2+H2O+CO2═Cu2(OH)2CO3]

试题篮
()