某小组发现实验室中盛放氧化钙的塑料瓶膨胀破裂。设计实验探究瓶中固体的成分。
步骤Ⅰ:取一定质量的固体平铺于试管中,通入足量水蒸气。一段时间后,将固体充分干燥并称量,质量不变。
步骤Ⅱ:另取等量固体于试管中,加水振荡,静置后观察到有白色沉淀。向试管中滴加酚酞试剂。上层清液变红。再加入稀盐酸,溶液由红色变为无色,有气泡产生,沉淀消失。
(1)用化学方程式表示塑料瓶膨胀破裂的主要原因 。
(2)由步骤Ⅰ推断固体中一定没有的物质是 。步骤Ⅱ最后所得溶液中溶质的可能组成是 (酚酞除外)。分析上述实验过程及现象,确定该固体的成分是 。
(3)上述实验中,通过测定某些量,还能确定固体中各成分的质量比。若选择加入一种过量的其它类别物质的溶液代替稀盐酸,也能达成此目的,加入的溶液是 ;确定该溶液过量,所选的试剂是 。
水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
[猜想与假设](1)该混合气体只含有一氧化碳、氢气;
(2)该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气;
(3)该混合气体只含有二氧化碳、氢气和水蒸气;
(4)该混合气体只含有一氧化碳、二氧化碳和氢气。
[查阅资料](1)无水硫酸铜遇水由白色变为蓝色;
(2)碱石灰是固体氢氧化钠和氧化钙的混合物;
(3)氢气与一氧化碳都具有还原性。
[收集证据]同学们在老师的指导下设计了如图1所示装置(部分夹持仪器已略去),并进行了实验。

(1)装置A中无水硫酸铜由白色变为蓝色,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有 。B中发生反应的化学方程式为 。
(2)反应前装置C中的药品为 溶液。
(3)反应后E中红色氧化铁粉末变为黑色,F中无水硫酸铜由白色变为蓝色,G中澄清石灰水变浑浊,说明混合气体中还存在的气体是 。
[实验结论]猜想 正确。
[实验反思]经过讨论,同学们将如图1装置进行了简化。只用如图2所示装置并自选必要试剂就能完成探究(假设每步都完全反应)。实验过程中干燥的凉烧杯内壁能观察到的现象是 ,应补充的最后一步实验操作及现象是 。

皮蛋是我国一种传统风味蛋制品。某化学课外小组的同学查阅资料后得知,腌制皮蛋的主要原料有:生石灰、纯碱和食盐。同学们向这三种物质中加入足量水,充分搅拌,过滤,对滤液中溶质的成分进行探究。
小组同学讨论后一致认为,滤液中的溶质一定含有NaOH和 (填化学式)。一定含有NaOH的原因是①CaO+H2O═Ca(OH)2;② (用化学方程式表示)。
【提出问题】滤液中还可能含有哪些溶质?
【作出猜想】猜想①:Ca(OH)2
猜想②:Na2CO3
【实验探究】同学们分别设计了如下两种方案并进行实验:
方案一:甲同学取少量滤液于试管中,通入二氧化碳气体,没有观察到明显现象。从而得出猜想②成立。同学们一致认为,通过该实验不足以得出其结论,原因是 。
方案二:乙和丙同学分别取少量滤液于试管中,滴加稀盐酸。乙同学观察到 ,证明猜想②正确。丙同学却没有观察到明显现象,你认为原因可能是 。
【拓展延伸】证明猜想②正确后,同学们想进一步通过实验证明滤液中存在NaOH.于是,继续进行如下探究:
【查阅资料】氯化钡溶液显中性。
【实验探究】
实验操作 |
实验现象 |
实验结论 |
步骤Ⅰ:取少量滤液于试管中,滴加过量氯化钡溶液,静置 |
有白色沉淀产生 |
滤液中含有NaOH |
步骤Ⅱ:取步骤Ⅰ中的上层清液少量于试管中,滴加酚酞溶液 |
|
【反思评价】丁同学认为步骤Ⅱ中的酚酞溶液也可用硫酸镁溶液替代,你是否同意他的观点,并说明理由: 。
饮水安全是脱贫攻坚“两不愁、三保障、安全”的重要内容和指标,关乎百姓生命健康,必须对天然水进行净化达标后才能饮用。
(1)在净化水的过程中常用 来吸附水中的色素和异味,用二氧化氯(ClO2)消毒杀菌,二氧化氯中氯元素的化合价为 。
(2)某同学在使用“除垢剂”去除热水瓶中的水垢时,发现有气泡产生。根据水垢的主要成分含有碳酸钙等物质,猜想到“除垢剂”的有效成分中可能含有酸。于是,他分别设计了在家庭中和实验室用两类不同物质且产生两种不同现象的实验方案验证自己的猜想,请完成实验报告。
实验步骤 |
实验现象 |
实验结论 |
家庭中:取适量“除垢剂”于瓷碗中,向其中加入 。 |
|
“除垢剂”的有效成分中一定含有酸。 |
实验室:取适量“除垢剂”于试管中,向其中加入 。 |
|
根据实验结论,得出使用“除垢剂”时的注意事项有 (写一条)。
某教师在进行“常见的碱”的教学时做了以下演示实验:取少量纯净的氢氧化钠固体于50mL干燥的烧杯中,置于电子天平上。一段时间后,氢氧化钠固体表面出现了液体,天平示数增加。取下烧杯,将其放置在空气中。一周后,向烧杯中加适量水配制成溶液,取少量烧杯中的溶液于试管中,滴加足量稀盐酸,观察到有气泡冒出。
[交流与解释]
(1)氢氧化钠固体表面出现液体是因为氢氧化钠吸收空气中的水分而潮解。
(2)电子天平示数增加的原因除了吸收水分以外,还有另一个原因是 (用化学方程式表示)。
教师安排兴趣小组同学对烧杯中的溶液是否还含有氢氧化钠进行了以下探究。
[作出猜想]猜想一:有氢氧化钠
猜想二:没有氢氧化钠
[查阅资料]BaCl2溶液、NaNO3溶液、Ba(NO3)2溶液均呈中性。
[进行实验]小明同学取少量烧杯中的溶液于试管中,滴入几滴无色酚酞,观察到溶液变红,小明同学认为猜想一成立。
[交流与评价]小玲同学认为小明同学的结论不一定正确,原因是 。于是,小玲同学继续进行探究。
[进行实验]
实验操作 |
实验现象 |
实验结论 |
小玲同学在小明同学所做实验后的溶液中,滴入足量的Ba(NO3)2溶液, |
|
猜想一成立 |
[反思与拓展]
(1)根据氢氧化钠固体易潮解的性质,可用氢氧化钠固体作某些气体的 。
(2)另取少量烧杯中的溶液进行以下实验,也能证明猜想一成立的是 (填序号)。
A.先加足量稀盐酸,再滴加紫色石蕊溶液
B.先加足量BaCl2溶液,静置,取上层清液,再滴加CuCl2溶液
C.先加足量Ca(OH)2溶液,静置,取上层清液,再滴加酚酞溶液
D.先加足量Ba(NO3)2溶液,静置,取上层清液,再滴加FeCl3溶液
明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐内,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是( )
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:ZnCO3+2C Zn+3CO↑
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。

(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
[实验探究Ⅱ]
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。

(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在 范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色 (填“一定”或“不一定”)变红。
某品牌干燥剂含有氧化钙、氢氧化钠和氯化钙中的两种物质,为探究其组成,某化学兴趣小组取一定质量的干燥剂样品做了如下实验。
【查阅资料】稀硝酸(HNO 3)具有酸的通性
【设计实验】流程如图:

【实验分析】(1)干燥剂样品溶于水后得到的溶液一定显 (填"酸性"或"碱性"或"中性")。白色沉淀a的化学式是 。
(2)生成气体b的反应的化学方程式是 。
【结论与反思】(1)若c处无现象,则该品牌干燥剂的成分为 (写化学式)。
(2)若c处有白色沉淀生成,且沉淀质量为2.87g;白色沉淀a的质量为1.2g。则干燥剂的成分为 (写化学式)。写出c处产生白色沉淀的化学方程式 。
(3)该实验过程中,过量稀硝酸不能用过量的稀盐酸代替的原因是 。
实验是学习化学的一条重要途径。请回答问题:

(1)如图一,观察到蜡烛燃烧时火焰分为a、b、c三层,其中温度最高的是 (填字母序号)。
(2)如图二,取一个冷而干燥的小烧杯罩在火焰上方,观察到烧杯内壁出现 ,快速倒转烧杯,倒入少量澄清石灰水,振荡,观察到澄清石灰水变浑浊。由此可知,蜡烛燃烧后的产物一定有H2O和 (填化学式)。
(3)如果用一个大烧杯扣住蜡烛(如图三),一段时间后,观察到蜡烛熄灭,说明燃烧需要 。
(4)为测定某有机物的组成(如图四),往装置中先通入一段时间干燥的氮气,再将6.4g样品在氧气中燃烧后的产物(样品无剩余)依次通过装置A、B、C、D(装置中涉及的每步反应均反应完全),结果发现装置A增重7.2g,装置C增重8.8g。试分析:
①装置A中利用了浓硫酸的 。
②装置B中红色粉末变成黑色的原因是 (用化学方程式表示)。
③装置C中反应的化学方程式为 。
④由此可知,该有机物化学式中碳、氧原子的个数比为 (填最简整数比)。
某化学兴趣小组同学做了实验后在整理实验室时,得到白色固体药品,查阅药品记录单可知,可能是碳酸钠、碳酸氢钠和硫酸钠中的两种物质的混合物。为探究其成分,进行如下探究活动:
[猜想与假设]针对其组成:
猜想一:含有Na2CO3和Na2SO4;
猜想二:含有Na2SO4和NaHCO3;
猜想三:含有 。
[实检探究]
实验Ⅰ:取白色固体于试管中加热,将产生的无色无味气体通入澄清石灰水,澄清石灰水变浑浊。
实验Ⅱ:取加热后的白色固体于试管中加足量的盐酸后,再滴加氯化钡溶液,立即产生白色沉淀。
[实验分析及结论]
(1)实验Ⅰ中,产生无色无味气体反应的化学方程式为 。实验Ⅱ中,滴加氯化钡溶液产生白色沉淀反应的化学方程式为 。
(2)实验Ⅰ中可判断猜想 不成立。
综合实验Ⅰ、Ⅱ,可判断猜想 不成立。
[拓展延伸]
若Na2SO4溶液中混有少量的NaHCO3,提纯Na2SO4溶液的实验方案是 。
有一瓶气体,可能由O2、CO、CO2中的一种或几种组成为确定其组成,在老师的指导下,实验小组对该瓶气体进行了如下探究:
【查阅资料】脱氧剂(还原铁粉能够吸收氧气和水蒸气)。
【实验设计】用如图所示的装置进行实验(已略去夹持装置)。

【实验步骤】①检查装置气密性;②通入一定量氮气;③通入该气体,点燃酒精灯。
【实验现象】步骤③实验过程中,A装置无现象,B和F装置出现白色沉淀,E装置中出现光亮的红色物质。
【实验结论】该气体由 组成。
【实验反思】
(1)C装置的作用是 。
(2)步骤②通入一定量氮气的目的是 。
(3)E装置中氧化铜粉末发生反应的化学方程式为 。
小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
某同学为探究碳在氧气中不完全燃烧的气体产物中,既可能有一氧化碳,又可能有二氧化碳,他设计了如图所示实验:
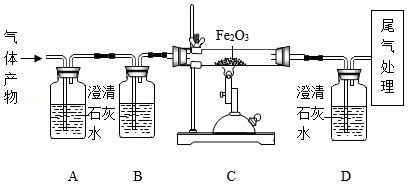
(1)装置A的作用是 。
(2)实验过程中,观察到装置C中玻璃管里的红棕色粉末逐渐变黑,说明原气体产物中含有一氧化碳,反应的化学方程式是 。
(3)通过观察装置D中澄清石灰水变浑浊,也能验证原气体产物中一氧化碳的存在,则装置B中应选择的试剂是 。
A.足量的氢氧化钠浓溶液
B.浓硫酸
C.水
(4)写出尾气处理的一种方法: 。
如图所示,某实验小组的同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、从微观角度分析,中和反应的实质是 。
Ⅱ、探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想①:可能是NaCl和NaOH;
猜想②:可能只有NaCl;
猜想③:可能是 。
【查阅资料】氯化钠溶液呈中性。
【进行实验】
| 实验方案 |
实验操作 |
实验现象 |
实验结论 |
| 方案一 |
取少量烧杯内溶液于试管,滴入几滴酚酞溶液,振荡 |
溶液 色 |
猜想①不正确 |
| 方案二 |
取少量烧杯内溶液于另一支试管 中,逐滴加入碳酸钠溶液至过量 |
|
猜想②不正确,猜想③正确 |
方案二发生反应的化学方程式是 。
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)。
A.pH试纸
B.铜
C.紫色石蕊溶液

试题篮
()