请分析下列实验装置,阅读所给材料,回答问题:

材料:氨气(NH 3)常温下是一种具有刺激性气味的无色气体,对人体有较大毒性,密度比空气小,极易溶于水,其水溶液显碱性。实验室可用加热氯化铵(NH 4Cl)和熟石灰两种固体的方法制取氨气,同时生成氯化钙和水。铵盐易溶于水,Ca(OH) 2微溶于水,CaCl 2溶液显中性,NH 4Cl溶液显酸性。
(1)实验室制取氨气的化学方程式为 ,应选取的发生装置是 (填装置编号)。
(2)用C装置收集氨气时,气体应从 口通入(填"a"或"b");检验氨气可用湿润的 石蕊试纸(填"红色"或"蓝色")。
(3)某同学对充分反应后反应器内的固体物质做进一步研究:
【提出问题】固体物质的成分是什么?
【作出猜想】猜想I:Ca(OH) 2、NH 4Cl和CaCl 2
猜想II:Ca(OH) 2和CaCl 2
猜想III:NH 4Cl和CaCl 2
猜想IV:只有CaCl 2
有同学对上述猜想提出质疑:有一种猜想不合理。你认为是 。
【实验探究】①取反应器内少量固体于试管中,加水溶解、过滤,得到滤液。
②取少量溶液于试管中,滴加无色酚酞试液溶液,颜色无变化,说明 I (填一种猜想)不正确。
③再取少量滤液于另一试管中,滴加AgNO 3溶液,产生白色沉淀,该同学认为固体中含有NH 4Cl,于是得出结论猜想III正确。你认为该同学的结论 (填"合理"或"不合理"),理由是 。
【评价反思】该同学认为实验装置仍有不足之处,请你提出改进措施: 。
有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。小金同学为探究其成分完成了以下实验:
①取少量白色固体溶于水,得到无色溶液,等分为两份;
②往一份无色溶液中加入稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的CO2,产生白色沉淀。
请回答:
(1)仅根据②推测原样品中一定不存在的物质是 ;
(2)原样品的所有可能组成是 。

图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:

(1)在图一所示的实验中,试管②中发生反应的化学方程式是 。
(2)甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是 (填序号)
A.试管②反应后的固体中一定不含铁
B.完全反应后,甲烧杯中的固体一定含有铁
C.完全反应后,甲烧杯的溶液中可能含有Cu2+
D.完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+
(3)乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管④反应后的溶液中的溶质共有哪些 (写化学式)。
(4)将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
实验操作 |
实验现象 |
实验结论 |
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液, |
有白色沉淀生成 |
①生成的白色沉淀是 (写 化学式,下同) ②滤液中的溶质共有哪些 |
步骤2:静置,向上层清夜中滴加无色酚酞试液 |
溶液变红 |
(5)在上述(4)的实验探究中,步骤1中加入足量硝酸钡溶液的目的是 。
实验室有一包混有少量锌粉和碳粉的碳酸钙粉末,化学兴趣小组的同学对其产生了兴趣,为验证其组成,兴趣小组的同学按如图所示装置(部分承持装置已略去)进行了如下实验探究。
(1)将混合物置于锥形瓶中并加入足量的稀盐酸,充分反应后,在乙、丙两处分别收集到两种气体,将乙处气体导入澄清石灰水,石灰水变浑浊,丙处的气体经验纯可以在空气中安静地燃烧。
①写出产生乙处所得气体的化学方程式 。由此证明混合物中含有碳酸钙。
②写出产生丙处所得气体的化学方程式 。由此证明混合物中含有锌。
(2)将甲处反应后的剩余物过滤、干燥并与氧化铜粉末高温加热,观察到黑色粉末逐渐变红。实验证明该混合物确实存在 。(填化学式)

雾霾已经成为人类健康的隐形杀手,防治雾霾污染是当前化学研究的重要内容。
(1)如图是一种鼻用空气净化器,主要材料是硅胶。净化器中的硅胶结构疏松多孔,对PM2.5的吸收率达99%,说明其具有 性。
(2)目前,国内重型柴油车尾气污染物减排的原理是:在一定条件下,车用尿素溶液先转化为NH3,NH3再与发动机排出的NO反应生成氮气和水。NH3与NO反应的化学方程式是 。
(3)某同学收集了某地区的雾霾,将其溶于水后得到试样溶液,该试样溶液中可能含有NH4NO3、NaNO3、BaCl2、MgCl2、Na2SO4五种物质中的一种或几种,为确定试样溶液的成分,设计并完成了如图2所示实验。
①白色沉淀D的化学式是 。
②试样溶液加入过量M溶液时生成X的化学反应方程式是 。
③根据以上实验可以判断该试样溶液中一定含有上述五种物质中的 (写化学式)。
有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。小金同学为探究其成分完成了以下实验:
①取少量白色固体溶于水,得到无色溶液,等分为两份;
②往一份无色溶液中加入稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的CO2,产生白色沉淀。
请回答:
(1)仅根据②推测原样品中一定不存在的物质是 ;
(2)原样品的所有可能组成是 。

固体混合物A可能含有CaO、NaCl、NH 4Cl、Na 2CO 3、Na 2SO 4五种物质中的一种或几种,为确定其成分,按如图所示进行实验:

请回答下列问题:
(1)A中还不能确定是否存在的物质是 (填化学式)。
(2)气体B能使无色酚酞溶液变 (填"蓝色"、"红色"或"紫色")
(3)②中生成白色沉淀F的化学方程式 。
(4)③中生成气体H的化学方程式 。
某化学兴趣小组在进行酸碱中和反应的实验时,先向烧杯中加入适量稀盐酸,并滴加几滴酚酞溶液,然后用滴管慢慢滴入稀氢氧化钠溶液,并不断搅拌,一会儿后停止滴加氢氧化钠溶液,观察到烧杯中溶液为无色。同学们对反应后的溶液M的成分进行如下探究:
【猜想假设】
猜想Ⅰ:氢氧化钠过量,溶液M呈碱性。
猜想Ⅱ:氢氧化钠与盐酸恰好完全中和,溶液M呈中性。
猜想Ⅲ: 。
同学们经过讨论后认为猜想Ⅰ不正确,其理由是 。
【实验探究】
(1)为了验证自己的猜想,小明设计了实验方案一:
实验步骤 |
实验现象 |
实验结论 |
取少量溶液M于试管中,滴加紫色石蕊溶液 |
溶液显 紫 色 |
猜想Ⅱ正确 |
(2)小强设计了实验方案二:
实验步骤 |
实验现象 |
实验结论 |
取少量溶液M于试管中,滴加硝酸银溶液和稀硝酸 |
产生白色沉淀 |
猜想Ⅲ正确 |
【分析评价】同学们对小强的实验方案进行了分析,认为他的实验结论不正确。如果猜想Ⅱ正确,按照方案二的实验操作,也会生成白色沉淀,此时发生反应的化学方程式为 。
【再次探究】
如果要验证猜想Ⅲ正确,可以设计实验方案三:取少量溶液M于试管中。然后分别加入下列物质进行实验,能观察到明显现象并得出正确结论的是 (填序号)。
①锌粒 ②铜丝 ③二氧化碳 ④氧化铁 ⑤氢氧化钾 ⑥硫酸铜 ⑦碳酸钙 ⑧硝酸铵
【拓展应用】若将等质量、等质量分数的氢氧化钾溶液与硝酸溶液混合。充分反应,则所得溶液中含有的溶质是 。
现欲探究一固体混合物A的成分,已知其中可能含有Na2CO3、NaC1、Ba(NO3)2、Cu(NO3)2四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。

试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为 。
(2)写出实验过程①中生成沉淀D的一个化学方程式: 。
(3)滤液E中肯定大量存在的酸根离子为 (写离子符号)。
(4)混合物A中,还不能确定存在的物质是 (写化学式),要进一步确定其是否存在,可用固体混合物A的样品进行再实验,请简要说明实验操作步骤、发生的现象及结论: 。
维C泡腾片是一种常见的补充维生素C的保健品。某品牌维C泡腾片(以下称“本品”)的主要成分如图1所示。
(1)下列关于维生素C的说法正确的是 (填字母)。
a.维生素C由C、H、O三种元素组成
b.维生素C的相对分子质量为176g
C.维生素C由6个碳原子、8个氢原子和6个氧原子构成
d.维生素C中C、H、O元素的质量比为9:1:12
(2)阅读本品的营养成分表:每100g维C泡腾片含钠5750mg(1mg=10﹣3g)。已知本品其他成分不含钠元素,则本品中碳酸氢钠的质量分数为 。
(3)维C泡腾片水溶液酸碱性的测定:将本品一片投入蒸馏水中,有气泡产生,反应原理为:H3C6H5O2+3NaHCO3=Na3C6H5O2+3CO2↑+3 (填化学式)。
待不再产生气体后,测得溶液呈酸性。
(4)维C泡腾片中碳酸氢钠质量分数的测定:称量相关实验用品质量,将本品一片投入蒸馏水中,待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图2所示。
相关数据如表:
物品 |
反应前 |
反应后 |
||
锥形瓶 |
蒸馏水 |
维C泡腾片 |
锥形瓶及瓶内所有物质 |
|
质量/g |
71.75 |
50.00 |
4.00 |
125.53 |
①根据以上数据计算本品中碳酸氢钠的质量分数(写出计算过程,结果精确到0.1%)。
②实验测定结果与题(2)计算结果相比有明显偏差,其可能原因是 。

有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。
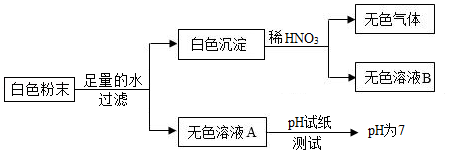
则:(1)无色溶液A中一定含有的溶质是 。
(2)白色粉末的成分是 。
水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
[猜想与假设](1)该混合气体只含有一氧化碳、氢气;
(2)该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气;
(3)该混合气体只含有二氧化碳、氢气和水蒸气;
(4)该混合气体只含有一氧化碳、二氧化碳和氢气。
[查阅资料](1)无水硫酸铜遇水由白色变为蓝色;
(2)碱石灰是固体氢氧化钠和氧化钙的混合物;
(3)氢气与一氧化碳都具有还原性。
[收集证据]同学们在老师的指导下设计了如图1所示装置(部分夹持仪器已略去),并进行了实验。

(1)装置A中无水硫酸铜由白色变为蓝色,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有 。B中发生反应的化学方程式为 。
(2)反应前装置C中的药品为 溶液。
(3)反应后E中红色氧化铁粉末变为黑色,F中无水硫酸铜由白色变为蓝色,G中澄清石灰水变浑浊,说明混合气体中还存在的气体是 。
[实验结论]猜想 正确。
[实验反思]经过讨论,同学们将如图1装置进行了简化。只用如图2所示装置并自选必要试剂就能完成探究(假设每步都完全反应)。实验过程中干燥的凉烧杯内壁能观察到的现象是 ,应补充的最后一步实验操作及现象是 。

某校化学实验室有一包固体废弃物,可能由铁粉、碳粉、碳酸钠、氧化铜、氯化钠、氢氧化钾中的一种或几种组成。为确定其成分,同学们取样进行了如图实验:
【实验一】

(1)操作Ⅰ的名称是 。
(2)向固体A中加入足量稀盐酸充分反应,没有气泡冒出,固体未完全溶解,溶液由无色变成蓝色,说明原废弃物中一定有 (填化学式,下同),一定没有 ,发生反应的化学方程式是 。
【实验二】
步骤一:

步骤二:
取混合物D中的上层清液少许,滴加酚酞溶液,溶液变红。
(3)混合物D中有白色沉淀,则原废弃物中有 ,发生反应的化学方程式是 。
(4)向混合物D中加过量稀硝酸的现象是 ,加入稀硝酸后一定发生反应的化学方程式是 (写一个)。
(5)混合物F中有白色沉淀,其上层清液中一定含有的溶质是 。
【反思与交流】
(6)小鹏对实验二进行了反思,发现混合物D的上层清液中能使酚酞变红的物质的可能组合一共有 种,所以原废弃物中还有物质不能确认是否存在。为了确认其是否存在,且不影响其他物质的检验,需要对步骤一中某一种试剂的使用做出如下修改: 。
某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用如图的装置探究其成分,已知无水硫酸铜遇水会变蓝色。

(1)甲装置中盛放的液体是 。
(2)实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有 (填化学式),同时乙装置中黑色固体变 色。
碳铵是一种常用的化肥,它在常温下易分解,某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
[查阅资料]氨气具有刺激性气味,极易溶于水,其水溶液呈碱性:氨气能使湿润的红色石蕊试纸变蓝:氨气不与碱石灰反应。
Ⅰ、检验溶液中的阴、阳离子。
取少量碳铵放入试管中,加入盐酸,把生成的无色无味的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有的阴离子可能是 和 (填离子符号)。
(2)根据实验现象,碳铵与浓NaOH溶液加热反应生成了 (填化学式)气体。
Ⅱ.测定碳铵中C元素和N元素质量比。在此过程中,用到如图1所示装置,请回答:
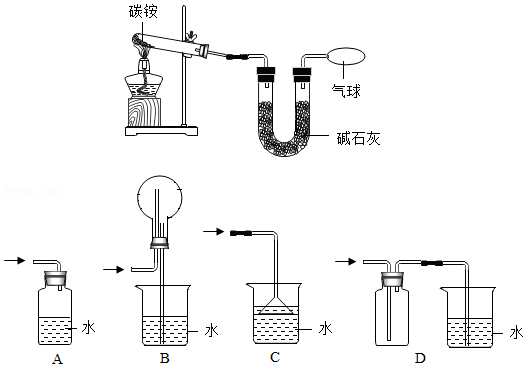
(3)给碳铵固体加热时,试管口略向下倾斜的原因是 。
(4)从安全和环保的角度考虑,本实验可以用如图1所示的气球来收集尾气,还可以选用如图2所示的 (填序号)装置来处理尾气。
试题篮
()