小丽对家中的家用制氧机产生了浓厚的兴趣。她通过阅读说明书了解到家用制氧机的工作原理如下:加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气。减压时,分子筛将所吸附的氮气排放。整个过程中,分子筛并不消耗。小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气。
【实验记录】
| 使用步骤 |
实验现象 |
化学方程式 |
| 取一只250mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 |
木炭燃烧得更旺 |
化学方程式Ⅰ |
表中,化学方程式Ⅰ是 。
【实验结论】收集的气体是纯净的氧气。
【实验反思】老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气。该实验不
能证明所收集气体为纯净氧气的原因是 。
实验II:测定小丽所带气体中氧气的含量。
同学们在老师的指导下设计了如图所示装置,进行实验,并重复多次。
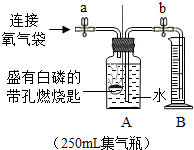
【实验记录】
| 实验操作 |
主要实验现象 |
实验结论及解释 |
|
| ① |
检查装置的气密性 |
|
装置的气密性良好 |
| ② |
加入药品,将装置连接固定 |
|
|
| ③ |
打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b |
A中水进入到B中,B中水的体积为200mL。 |
收集200mL气体(由压强差引起的误差忽略不计) |
| ④ |
用凸透镜聚光引燃白磷 |
燃烧,产生大量白烟 |
|
| ⑤ |
待白磷熄灭并冷却到室温, 打开止水夹 |
现象Ⅰ |
小丽收集的气体不是纯净的氧气 |
表中,现象I是 。
白磷燃烧的化学方程式是 。
【数据记录】
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
| B中剩余水体积/mL |
100 |
42 |
39 |
41 |
38 |
【数据处理】在上表数据中,第1组数据偏差较大,存在明显误差,在数据处理时应删去。
小丽所带气体中氧气的体积分数为 %。
【实验反思】
(1)这台家用制氧机制氧气的过程发生的变化属于 (填“物理变化”或“化
学变化”)。
(2)导致第1组数据产生较大误差的可能原因是 。
某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。(1)该反应的化学方程式为________________________________。
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:
①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③_______________。
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况_____(填序号)是不可能的。
为了进一步确定溶液的成分,同学们设计了如下实验方案:
| 实验步骤 |
现象 |
结论 |
| |
|
情况①正确 |
在同学们的合作下,他们顺利完成了探究任务。
某同学设计如图所示的实验装置,进行一氧化碳还原氧化铜的实验。试回答:
(1)该装置存在的一个主要问题是 :改进措施是 。(2)实验开始时,是先加热氧化铜,还是先通入一氧化碳? ,目的是为 。
(3)实验过程中,图中A处观察到的实验现象是 ;A处发生反应的化学方程式为 ;B处观察到的实验现象是 。
竹子是“有节、中空、四季常绿”的植物(如图所示)。同学们对竹子中的气体成分展开了探究,测定其成分。
(1)收集竹子中的气体。
小华提出:将一节竹子浸没在水中,在竹子上钻孔,用排水法收集气体。
小刚提出:可用注射器从竹子中抽取气体。
大家认为两人的想法都可行,于是分为A、B两组,在相同的条件下,A组采用小华的取气方法,B组采用小刚的取气方法,分别完成下面的实验。
(2)检验气体中是否含有二氧化碳气体。
| 实验步骤 |
实验现象 |
实验结论及解释 |
| 向所取气体中加入 |
|
有二氧化碳,化学方程式为: |
(3)测定气体中氧气含量。
【查阅资料】红磷的着火点为240℃,白磷的着火点为40℃。
【设计实验】同学们设计了如下图所示的方案一和方案二来测定氧气含量。
【进行实验】按上述两个方案进行多次实验。
【反思与评价】
①实验中磷的量应为足量,目的是 ;
②两个方案的实验测定结果不同,测定结果比较准确的是方案 ,原因是 。
③经过A、B两组同学的实验,A组测得的含氧量总是大于B组的,你认为原因是 。
请你和小明一起进行实验室制取二氧化碳的探究。
(一)选择药品:小明对三组药品进行了研究,实验记录如下:
| 组别 |
药 品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
粉末状石灰石和稀盐酸 |
产生气泡速率很快 |
对照实验①②,是在探究不同的酸因素对制取二氧化碳气体产生影响;
对照实验①③,是在探究 对制取二氧化碳气体产生影响;
小明选择第①组药品来制取二氧化碳,该组药品发生反应的化学方程式为
;
不选择第②组药品的原因是 。
(二)选择装置:
(1)写出图中带标号仪器的名称:① ,② 。
(2)小明选择气体发生和收集的装置为 请在A~E中选择),验满方法是 。
(3)将生成的气体通入石蕊溶液中,溶液变红,请你写出反应的化学方程式: 。
(4)装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的,起到随开随关的作用。
铁质水龙头长期使用容易生锈,小明从自家水龙头上取下一些铁锈样品,用图甲所示的装置进行实验。 
(1)B处澄清石灰水变浑浊,反应方程式为 ,C处酒精灯的作用是
(2)实验结束,小明将所得的黑色固体物质放入足量的稀硫酸中,发现没有气泡,这说明生成物中 (有或没有)铁。
为解释这个现象,小明查阅下列资料:
Ⅰ.已知铁的氧化物有FeO、Fe3O4、Fe2O3,,在一定条件下,均能逐步失去其中的氧,最终被还原为铁。
Ⅱ.某炼铁厂对氧化铁和一氧化碳进行热反应分析,获得相关数据并绘制成下图。
通过分析资料确定:
①700℃时氧化铁和一氧化碳进行反应的产物是 (填FeO或Fe3O4或Fe).
②小明实验失败的主要原因是 。
(1)目前世界上一半以上的铜用于电力和电信工业,是因为铜具有 (填字母)
| A.导热性 | B.延展性 | C.导电性 | D.金属光泽 |
(2)我国第四套人民币的硬币从1999年开始发行,一元为钢芯镀镍(Ni ),五角币为钢芯镀铜合金,一角币为铝合金或不锈钢。在选择铸造硬币的材料时需要考虑的因素是有 (填一条即可)。
①镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍的化合物,并放出氢气。其反应没有铁与酸反应剧烈。镍与盐酸反应的化学方程式为 .
②用镍片、硫酸亚铁溶液和 溶液做实验也能判断Ni 、Fe、Cu的金属活动性顺序。三种金属的活动性顺序为 。
(3)若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 。
(4)活动课上小明将一枚五角币放在酒精灯火焰上加热片刻,发现表面变黑。
【假设与预测】假设Ⅰ:五角币加热变黑,是因为酒精灯内焰的黑烟附着在五角币的镀铜上;
假设Ⅱ:五角币加热变黑,是因为五角币上的镀铜与 ______发生了化学反应。
【实验与事实】
实验一: 用洁净的干布擦一擦五角币上的黑色物质,黑色物质不易被擦去;再另取一枚五角币放在石棉网上,用酒精灯加热片刻,五角币也变黑。
实验二:取一块铜片放入小试管中并塞上橡皮塞,然后用酒精灯加热直至试管中铜片变黑;再将铜片反转到另一面,加热片刻,铜片不再变黑。
【解释与结论】上述实验一和实验二证实,假设 __ ___ 不成立。
【表达与交流】铜片在空气中加热,发生的化学反应方程式为___ ___ 。
在化学课上,甲同学将燃烧的钠(Na)迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.老师告诉同学们,这种黑色颗粒和白色物质都是化学实验室中的常用药品之一。
【提出问题】黑色颗粒和白色物质分别是什么?
【进行猜想】甲认为黑色颗粒是 炭(C),白色物质可能是碳酸钠( Na2CO3)或氧化钠(Na2O),乙同学还认为白色物质是氢氧化钠(NaOH).经过分析甲同学认为乙同学的猜想是错误的,其理由是_______________________,
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠,氢氧化钠与盐酸反应生成氯化钠和水。碳酸钠也是白色粉末,与盐酸反应会产生二氧化碳、水、氯化钠。
【实验探究】甲同学对黑色颗粒,白色物质分别是什么物质进行实验探究.
| 实验步骤 |
实验操作 |
实验现象 |
结论 |
| 步骤1 |
在氧气流中充分燃烧黑色固体,并把产生的气体通入澄清石灰水中 |
黑色固体完全消失,澄清石灰水变浑浊 |
黑色固体是____________ |
| 步骤2 |
取少量白色固体于试管中,加入适量水,振荡,样品全部溶于水,向其中加入盐酸 |
产生气泡 |
白色固体是___________ |
【拓展反思】通过这个实验,你对燃烧条件有什么新的认识?_______________________________________________
某化学兴趣小组的同学为了探究铁生锈的因素,设计了如图装置(气密性良好)进行实验。实验时,将一枚洁净的钢钉放入食盐水中,一段时间后观察现象。请你一起参与分析,并完成后续实验设计。
【观察现象】①装置右侧U形管中的红墨水液面左高右低; ②铁钉生锈,试管底部有黑色固体物质。
【提出问题】U形管中的红墨水液面为何左高右低?黑色物质又是什么?
【理论分析】该小组的同学根据已学过的知识分析得知,红 墨水液面右高左低的原因是________________________。
【猜想与假设】该小组的芳芳同学猜测该黑色固体中可能含有Fe、Fe2O3、C三种物质中一种或几种。
【分析与验证】(1)小强认为一定含有碳,得到了大家的认可,理由是 ;(2)该小组同学不能确定黑色固体中是否含有铁,请你帮助他们设计方案进行确认:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量黑色固体于试管中, 滴加 。 |
________________ |
证明黑色固体中含有铁 |
【知识链接】相信你一定在家中做过铁钉分别在水中和食盐水中生锈的实验,你的结论是铁钉在 (填“水”或“食盐水”)中生锈较快。
注意:若答对以下小题将奖励4分,但化学试卷总分不超过60分。
【继续探究】请你设计实验探究影响铁钉生锈快慢的其他因素。(包括猜想、实验设计、现象和结论等环节)。
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
某化学兴趣小组回收利用废旧干电池。
实验1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如图1所示。
(1)操作1和操作2的名称都是___________,该操作中玻璃棒的作用是__________。
(2)灼烧滤渣l的目的是____________________________。
实验2利用外壳回收物锌制取氢气及相关探究
(3)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口接____(填“a”或“b”) 进;选用仪器F测量排出水的体积,仪器F名称是___________________。
(4)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 |
试 剂 |
前 10min 内产生的氢气体积(mL) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
|
|
| a |
纯锌 |
30mL 30% |
564.3 |
| b |
含杂质的锌 |
30mL 30% |
634.7 |
| c |
纯锌 |
30mL 20% |
449.3 |
| d |
纯锌 |
40mL 30% |
602.8 |
①比较实验a和实验b,可以得到的结论是__ __。
②为了研究硫酸浓度对反应快慢的影响,需比较实验___ _和实验____(填编号).
③控制其他条件相同,需控制的条件是__ __(列举一种条件即可)。
已知草酸 (H2C2O4) 加热时在浓硫酸的催化作用下会发生分解反应,某化学兴趣小组对草酸分解的产物产生了兴趣,请你参与:
【提出猜想】甲:CO2 H2O 乙: CO H2O
丙:NH3 CO2 H2O 丁: CO2 CO H2O
(1)某同学认为丙同学的猜想是错误的,理由是 。
【查阅资料】氧化铁为红棕色粉末,一定温度CO能还原氧化铁;铁粉呈黑色。
【进行实验】为了验证上述猜想,将草酸在一定条件下分解的产物依次通过下列装置:
(2)A、B装置的顺序不能颠倒,原因是 。
(3)实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红棕色粉末变成黑色,由此推断 同学猜想成立。
(4)D装置的作用是 ,反应的化学方程式为 。
【得出结论】(5)草酸分解的化学方程式为 。
【反思与评价】(6)从环保角度考虑,上述实验的不足之处是 。
某化学兴趣小组按右图所示装置(固定装置已省去)开展有关探究性实验。已知,过氧化氢足量,该装置气密性良好,实验前开关K1和K2均处于关闭状态。实验步骤如下:
Ⅰ.打开K1、K2,观察现象;
Ⅱ.关闭K1,打开分液漏斗活塞,观察现象;
Ⅲ.打开K1,观察现象;
Ⅳ.回收锥形瓶中的二氧化锰,洗净仪器放回原处。
回答下列问题:
(1)该实验的目的是 ;
(2)步骤Ⅲ观察到试管①中的现象是:有气泡从导
管中冒出、 ,试管①中反应的化学方程式为 ,该反应的类型是 反 应(填“化合”、“分解”或“置换”);
(3)实验完毕后,回收二氧化锰的实验操作是 、洗涤、干燥;
(4)由步骤Ⅱ、Ⅲ可得出的实验结论是 。
金属锌与稀硫酸反应生成硫酸锌和氢气,化学课外小组的同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小组同学用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数 (均取20mL) |
锌的形状 (均取1g) |
氢气的体积(mL) (均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
30% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)小组同学用右图装置收集并测量氢气的体积,其中量筒的作用是 ,氢气应从 (填e或f或g)管通入。(已知:氢气难溶于水)
【收集证据】
(2)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【得出结论】
(3)结论是 。
【评价与反思】
(4)下表是小组同学第①组实验的详细数据。
| 时段(均为1分钟) |
第1分钟 |
第2分钟 |
第3分钟 |
第4分钟 |
第5分钟 |
第6分钟 |
| H2的体积 |
3.1mL |
16.7mL |
11.9mL |
9.6mL |
7.6mL |
6.0mL |
请描述锌与硫酸反应快慢的变化 ,并解释第二分钟以后变化的原因 。
(5)锌与硫酸反应的快慢可能还受温度因素的影响,请设计实验验证 。
某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学探究该气体的成分。
【猜想与假设】
小华说:该气体可能是CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为 。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2、CO易燃易爆,同时CO也 。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
将气体通入澄清的石灰水中 |
澄清石灰水变浑浊 |
| ② |
将带火星的木条伸入该气体中 |
带火星的木条没有复燃 |
【得出结论】
(1)由实验①可知,该气体中肯定含有 ,写出该反应的化学方程式 。
(2)由实验② (填“能”或“不能”)确定该气体中不含氧气,理由是 。
某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度。于是,
同学们探究影响过氧化氢分解速度的某种因素。
【实验过程】实验数据记录如下:
| |
过氧化氢溶液的质量 |
过氧化氢溶液的浓度 |
MnO2的质量 |
测量数据 |
| Ⅰ |
50.0g |
1% |
0.1g |
9 mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16 mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式为 。
(2)表格中的“测量数据”的指的是:相同时间内 _。
(3)本实验中,测量O2体积的装置是 (填编号)。
【实验结论】
在相同条件下 。
【交流评价】
(1)甲同学提出在上述实验中测量 同样能得出相同的结论。
(2)乙同学提出用下图装置进行实验,通过比较 也能达到实验目的。
【实验反思】
除了上述因素会影响过氧化氢分解速度外, _(写一种)也会影响过氧化氢分解速度,你的实验方案是 。
试题篮
()