下列除去物质中少量的杂质,所选用的试剂和主要操作方法都正确的是( )
物质(括号内为杂质) |
所用试剂和主要操作方法 |
|
A |
ZnCl2溶液(CuCl2) |
加入足量的铁粉后过滤 |
B |
铜粉(木炭) |
在空气中灼烧 |
C |
CO2(CO) |
通入过量的氧气后点燃 |
D |
KCl(MnO2) |
加水充分溶解后过滤,蒸发结晶 |
A.AB.BC.CD.D
某学习小组将足量Zn条插入一定量的浓H2SO4中,发现Zn表面有大量气泡产生。(注:随着反应进行,硫酸浓度逐渐变小)
【提出问题】气体的成分是什么?
【猜想假设】猜想一:只有SO2
猜想二:只有H2
猜想三:
【查阅资料】(Ⅰ)SO2可以使品红溶液褪色
(Ⅱ)SO2可以和碱性溶液反应
(Ⅲ)H2+CuO Cu+H2O
【实验探究】用如图装置验证猜想(部分夹持仪器省略)
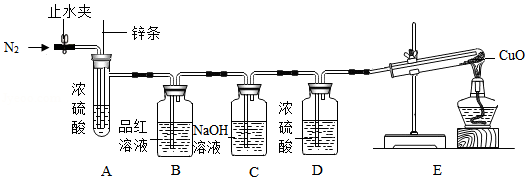
【方案设计】
主要实验步骤 |
主要现象 |
解释或结论 |
①打开止水夹,先通入一段时间N2 |
/ |
/ |
②关闭止水夹,将足量Zn条下放,浸入浓硫酸中,点燃E装置处酒精灯 |
B装置处品红溶液褪色 E装置处 |
猜想三成立 |
③结束实验 |
/ |
/ |
【表达交流】
(1)在步骤①中,通入N2的目的是: 。
(2)请你设计一个实验,用化学方法证明E装置中CuO未完全反应。
实验步骤 |
实验现象 |
结论 |
|
|
CuO未完全反应 |
【反思拓展】
(1)请你根据上述实验探究,补充Zn与浓硫酸反应的化学方程式
Zn+2H2SO4═ZnSO4+SO2↑+ 。
(2)已知Al与H2一样,在加热条件下能与CuO发生化学反应,请写出该反应的化学方程式 。
下列实验方案正确的是( )
选项 |
实验目的 |
实验方案 |
A |
除去CO2中混有的HCl气体 |
将混合气体通过装有足量NaOH溶液的洗气瓶 |
B |
鉴别Na2CO3溶液和NaCl溶液 |
取少许样品于两支试管中,分别滴加无色酚酞试液 |
C |
除去CaO中混有的CaCO3 |
将混合物溶于水后过滤 |
D |
除去MnO2中混有的KCl |
加水溶解、过滤、蒸发结晶 |
A.AB.BC.CD.D
过氧化氢能极缓慢分解,可看成分解为水和氧原子:H2O2→H2O+O,其水溶液显弱酸性。过氧化氢是实验室中重要化学试剂,在生产生活中有重要用途。回答下列问题:
(1)过氧化氢中氧元素的化合价为 。
(2)MnO2能加快过氧化氢分解,氧原子再结合成氧分子而制得氧气,MnO2在反应中作 剂,下列装置可用于制取氧气的是 (选填字母编号,下同),可用于收集氧气的装置有 。
(3)氧原子容易与许多有机物反应而破坏其结构,所以过氧化氢溶液能杀死新冠病毒,这个过程叫做蛋白质的 。
(4)向氢氧化钠溶液中滴加酚酞试液,再滴加过氧化氢溶液,观察到溶液先变红后褪色,猜想其褪色原因可能有两种:
①H2O2显酸性消耗了NaOH,而使红色褪去;
②H2O2分解产生的氧原子与酚酞反应破坏其结构,而使红色褪去。究竟哪种猜想合理?请用本次实验用过的试剂设计实验 (补充完实验方案)。有兴趣的同学可在后续学习中通过实验得出结论。
实验操作是学习化学必备的技能。下列除去杂质的化学原理和操作方法不能达到目的的是( )
选项 |
物质(括号内为杂质) |
操作方法 |
解释或相关的化学方程式 |
A |
铜粉(铁粉) |
用磁铁吸 |
磁铁能吸引铁粉而不能吸引铜粉,剩余物质为铜粉 |
B |
NaCl(Na2CO3) |
配成溶液,滴加过量的稀盐酸,振荡,蒸干 |
Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
C |
CO(CO2) |
将混合气体通过灼热的CuO |
CO+CuO Cu+CO2↑ |
D |
Na2CO3(NaHCO3) |
将混合物加热至质量不再减少为止 |
2NaHCO3 Na2CO3+H2O+CO2↑ |
A.AB.BC.CD.D
下列实验方案正确的是( )
选项 |
实验目的 |
实验方案 |
A |
除去铁钉表面的铁锈 |
将铁钉长时间浸泡在足量的稀盐酸中 |
B |
除去KCl溶液中含有的少量BaCl2 |
加入过量的K2CO3溶液,过滤 |
C |
鉴别稀硫酸和稀盐酸 |
分别加入Ba(NO3)2溶液,观察现象 |
D |
鉴别实验室中的食盐水和糖水 |
品尝味道 |
A.AB.BC.CD.D
某同学参加实验操作考试,为验证镁、锌、铜三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的的是( )
A.将镁片、锌片分别放入Cu(NO3)2溶液中
B.将锌片、铜片分别放入Mg(NO3)2溶液中
C.将镁片分别放入Zn(NO3)2溶液、Cu(NO3)2溶液中
D.将镁片、锌片、铜片分别放入稀盐酸中
下列实验操作(方案)不能达到实验目的(结果)的是( )
选项 |
实验操作(方案) |
实验目的(结果) |
A |
向试管中加入适量蒸馏水和2滴紫色石蕊溶液,通入CO2后振荡,再对试管加热 |
证明碳酸不稳定 |
B |
向试管中加入2mL浓氨水,将蘸有酚酞溶液的棉花靠近试管的管口 |
证明分子在不停运动 |
C |
将燃着的木条伸入集气瓶中 |
检验集气瓶中是否集满二氧化碳 |
D |
将固体药品放在托盘天平的右盘称量 |
称量结果可能偏小 |
A.AB.BC.CD.D
实验设计是实验探究的基本环节。下列实验设计能达到对应实验目的的是( )
选项 |
实验目的 |
实验设计 |
A |
除掉菜刀上的铁锈而不损坏菜刀 |
将菜刀长时间浸泡在稀盐酸中 |
B |
区分NaOH溶液与Ca(OH)2溶液 |
分别取少量,滴加Na2CO3溶液 |
C |
除去CO2中的CO气体 |
将气体通过NaOH溶液 |
D |
鉴别氮肥NH4NO3与(NH4)2SO4 |
取样,分别加入熟石灰研磨 |
A.AB.BC.CD.D
下列实验中,不能达到实验目的的是( )
实验 |
目的 |
方法 |
A |
除去NaOH溶液中混有的少量Na2CO3 |
加入适量的Ca(OH)2溶液,过滤 |
B |
除去NaCl溶液中混有少量MgCl2 |
加入适量的NaOH溶液,过滤 |
C |
鉴别稀盐酸和NaCl溶液 |
取样,分别加入AgNO3溶液,观察现象 |
D |
鉴别CO和H2气体 |
点燃,火焰上方罩干冷烧杯,观察现象 |
A.AB.BC.CD.D
忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是( )
选项 |
问题 |
分析与设计 |
A |
为何变质 |
2NaOH+CO2═Na2CO3+H2O |
B |
是否变质 |
取样,加入足量稀盐酸,观察是否产生气泡 |
C |
是否全部变质 |
取样,加入足量氯化钙溶液,观察产生沉淀多少 |
D |
如何除去杂质 |
取样,加入适量氢氧化钙溶液,过滤 |
A.AB.BC.CD.D
小明和兴趣小组同学利用铁与硫酸铜溶液反应,比较铁与铜的活动性强弱,发现铁丝表面有红色物质析出,溶液颜色由蓝色逐渐变为浅绿色,但有时会出现溶液颜色变为淡黄绿色或淡蓝色,甚至无明显变化的异常现象。
(1)针对上述异常现象,他们认为可能是溶液浓度或反应时间不同导致。为进一步探究此问题,请你设计实验方案并写出实验步骤 。
建议:①实验可设计4~5组;②实验时每支试管取用硫酸铜溶液5毫升;③每次实验总时间为20分钟。实验室提供铁丝、质量分数为16%的硫酸铜溶液、蒸馏水及其它实验所需的仪器。
(2)列举一个因反应物浓度不同导致实验现象不同的例子,写出反应物及现象 。
面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
“飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛的过程记录如下(“→”表示某一种物质经一步反应可转化为另一种物质)。
(1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学
甲同学:HCl→H2O
乙同学:HCl→H2O→□
乙同学在方框中应填物质的化学式是 (写一种即可)。
(2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学
丙同学:BaO→Ba(OH)2→BaSO4
下列能使丁同学获胜的方案有 (填字母)。
A.BaO→BaSO4→Ba(OH)2→BaCO3
B.BaO→BaCl2→Ba(NO3)2→BaSO4
C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4
D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4
试题篮
()