溶液是一种重要的混合物,下列有关溶液的说法正确的是( )
| A. |
溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动 |
| B. |
饱和溶液是一定温度下不能再溶解该物质的溶液 |
| C. |
不饱和溶液通过降低温度一定能变成饱和溶液 |
| D. |
一种物质分散到另一种物质里一定能形成溶液 |
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )

| A. |
操作I一定是降温 |
B. |
①与②的溶液质量一定相等 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表:
| 实验小组 |
第一组 |
第二组 |
第三组 |
第四组 |
| 水的质量/g |
50 |
50 |
50 |
50 |
| 所取NaCl的质量/g |
15 |
20 |
25 |
30 |
| 剩余NaCl的质量/g |
0 |
2 |
7 |
12 |
下列说法错误的是( )
| A. |
20℃时,50g NaCl饱和溶液中含有18g NaCl |
| B. |
用蒸发的方法可以使不饱和溶液变成饱和溶液 |
| C. |
第二组所得溶液的溶质与溶剂的质量比为9:25 |
| D. |
相同温度下,NaCl在水里的溶解度与水的质量无关 |
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
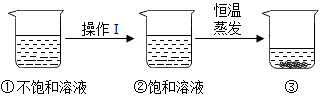
| A. |
操作Ⅰ一定是降温 |
B. |
操作Ⅰ一定是加溶质 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
X、Y、Z三种物质的溶解度曲线如图所示。下列说法正确的是( )

A.将T2℃时三种物质的饱和溶液降温到T1℃后,溶质质量分数大小关系为:Y>X>Z
B.Y的溶解度为50g
C.降低温度可使Z的不饱和溶液变成饱和溶液
D.T2℃时,50gH2O与50gX混合,可得到100gX的饱和溶液
某同学对下表中的溶解度数据分析后,得出的结论错误的是( )
温度/℃ |
0 |
20 |
40 |
60 |
氢氧化钙的溶解度/g |
0.18 |
0.16 |
0.14 |
0.11 |
硝酸钾的溶解度/g |
13.3 |
31.6 |
61.9 |
110 |
氯化钠的溶解度/g |
35.7 |
36 |
36.6 |
37.2 |
A.升温可将20℃时不饱和的Ca(OH)2溶液变为饱和溶液
B.60℃,饱和KNO3溶液的质量分数约为52.4%
C.温度变化对NaCl的溶解度影响较小
D.NaCl的溶解度大于KNO3的溶解度
甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
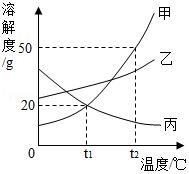
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
氯化钾(KCl)和氯酸钾(KClO3)的溶解度随温度变化曲线如图所示,下列说法正确的是 ( )

A.30℃时,KCl饱和溶液的溶质质量分数为35%
B.60℃时,a点对应KCl溶液恒温加水可变饱和
C.KCl的溶解度随温度变化的趋势比KClO3大
D.90℃150gKClO3饱和溶液降温到10℃可析出45g晶体
根据图示实验,下列说法正确的是( )

A.氯化钠溶液不能溶解其他溶质
B.20mL水中溶解氯化钠的最大质量是定值
C.加热后溶液中硝酸钾的质量分数变大
D.加热后硝酸钾溶液是不饱和溶液
试题篮
()