根据KNO3和NaCl的溶解度曲线,回答下列问题。
(1)30℃时,KNO3和NaCl中溶解度较大的是 。
(2)20℃时,使接近饱和的KNO3溶液变为该温度下的饱和溶液的方法之一是 。
(3)为了使NaCl溶液中的溶质全部析出,应采用的方法是 结晶。

某同学测得B物质的溶解度如表所示:
温度(℃) |
0 |
20 |
40 |
60 |
80 |
B物质的溶解度(g) |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
(1)根据表中测出的溶解度数据,在答题卡上相应位置画出B物质的溶解度曲线图。

(2)根据图1可知,T= ℃时,C物质的溶解度等于A物质的溶解度。
(3)要使接近饱和的A、B、C三种溶液都变为饱和溶液,可采用的相同方法是 (任填一种)。
(4)30℃时,将C物质的饱和溶液150g,稀释成质量分数为25%的溶液,需要向其中加水 g。
(5)如图2所示:常温下分别向装有适量A、C物质的两支试管里加入等量蒸馏水,充分振荡后,两支试管底部均有未溶解的固体。再将两支试管放入盛有冰水混合物的烧杯中,看到的实验现象是:装C物质的试管中固体增多,装A物质的试管中固体减少。请你对此现象做出解释: 。
水是一种重要的物质。
(1)用水可以获得氢气。请写出一个由水生成氢气的化学方程式 。
(2)水还可以用于鉴别物质。水鉴别氯化钠和硝酸铵依据的是 。
(3)水是最常见的溶剂。
①下列溶液用水作溶剂的是 (填字母序号);
A.生理盐水
B.碘酒
C.葡萄糖溶液
②将100g溶质质量分数为98%的浓硫酸稀释为溶质质量分数为10%的稀硫酸,需加水的质量为 g;
③如图为某物质在水中的溶解度曲线,欲使a点所示溶液变为b点,可采取的措施是 。
④20℃时,用精密仪器称量5.85g NaCl和7.90g NH4HCO3,放入盛有50.00g 水的烧杯中,充分搅拌,静置,有晶体析出。请结合下表分析,理论上析出的晶体及晶体的质量分别为 。
20℃时,五种物质在水中的溶解度
物质 |
NaCl |
NH4HCO3 |
NH4Cl |
NaHCO3 |
Na2CO3 |
溶解度/g |
36.0 |
21.0 |
37.2 |
9.6 |
21.5 |
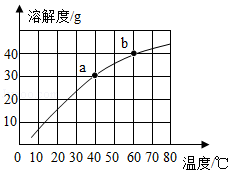
如图为甲、乙、丙三种固体物质(不形成结晶水合物)在水中随温度变化的溶解度曲线,按要求填空。
(1)在 ℃时,甲和丙的溶解度相等。
(2)t1℃时,将乙溶液的状态由M点变为N点,方法是 。
(3)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为 g。
(4)t3℃时,将125g丙的饱和溶液降温至t1℃,应再加入 g丙才能恰好达到饱和状态。

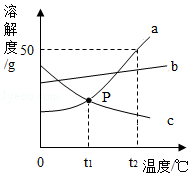
如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
(1)t1℃,a的溶解度 c的溶解度;(填“>”、“=”、“<”)
(2)t2℃时,将30ga物质放入50g水中充分溶解,所得溶液中溶质与溶剂质量比是 ;
(3)保持t2℃不变,要使接近饱和的b溶液变为饱和溶液,你采取的方法是
。
(4)现将t2℃时a、b、c三物质的饱和溶液降温到t1℃,所得溶液溶质质量分数大小关系为 。
如图是硝酸钾(KNO3)和氯化钾(KCl)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3 KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为 g。
(3)KNO3中混有少量的KCl,可用 的方法提纯KNO3。
(4)据图,下列有关说法正确的是 。
A.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
B.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
C.将60℃时KNO3和KCl两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
D.60℃时,从KNO3和KCl两种饱和溶液中获得等质量晶体,蒸发水较多的是KCl溶液

A、B、C三种物质的溶解度曲线如图。请回答下列问题。
(1)t1℃时,A物质的溶解度是 g。
(2)保持温度不变将B的不饱和溶液转化为饱和溶液,可采用的一种方法是 。
(3)将t2℃时等质量A、B、C三种物质的饱和溶液降温至t1℃,所得溶液中溶剂质量最少的是 。
(4)t1℃时将A、B、C三种物质各5g分别加入20g水中充分溶解,所得溶液质量的大小关系为 。

如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

如图是甲、乙两种固体物质的溶解度曲线。
(1)甲的溶解度随着温度的升高而 。
(2)使接近饱和的甲溶液变为饱和溶液的一种方法是 。
(3)t℃时,甲的饱和溶液中溶质与溶液的质量比为 。
(4)乙中含有少量甲,提纯乙可采用的方法是 。

如图为硝酸钾、氯化钠两种物质的溶解度曲线,据图回答下列问题。
(1)在 ℃时,硝酸钾和氯化钠的溶解度相等。
(2)将40℃时接近饱和的硝酸钾溶液变为饱和溶液,可采用 (填“升高”或“降低”)温度的方法。
(3)比较在40℃时硝酸钾和氯化钠饱和溶液的溶质质量分数,硝酸钾 氯化钠(填“>”“=”“<”)。

甲、乙、丙三种物质的溶解度曲线如图所示。请回答下列问题:
(1)在 0℃~60℃之间,三种物质中溶解度受温度影响最小的是 。
(2)20℃时,三种物质的溶解度由小到大的顺序为 。
(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是 。
(4)50℃时,将甲、乙、丙各20 g分别加入盛有50 g水的烧杯中,充分溶解,静置,然后各取上层清液m g,再降温至10℃,此时三种溶液中溶质的质量分数分别为ω(甲)、ω(乙)、ω(丙),则三者之间的大小关系是 。

甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示,请回答下列问题:
(I) t2℃时,甲、乙、丙三种物质溶解度大小关系是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,井恢复到原温度,所得溶液的质量为 g。
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法正确的是 。
A.甲中混有少量乙时,可用降温结晶的方法提纯甲;
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等;
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,溶质的质量分数相等;
D.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙。

甲、乙两种物质的溶解度曲线如图。
(1)A点的含义是 。
(2)t2℃时,甲、乙两种固体各8g分别投入25g水中,充分搅拌。
① (填“甲”或“乙”)所得溶液为不饱和溶液,若保持温度不变,加入溶质 g可使其达到饱和。
②乙所得溶液中溶质质量分数为 %。

将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是 (填字母编号)。
(2)0℃时,物质X的溶解度是 。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是 (填字母编号)。
(4)下列说法正确的是 (填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
试题篮
()