溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.硝酸钾
B.植物油
C.面粉
(2)下列有关溶液的说法中,正确的是 (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t 1℃时,甲、乙两种物质的溶解度 (填"相等"或"不相等")。
②t 2℃时,甲物质饱和溶液中溶质与溶剂的质量比为 (填最简比)。
③现有t 1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t 2℃,所得溶液中溶质质量分数大小关系是 (填序号)。
A.甲>乙>丙
B.甲=乙<丙
C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为 g.若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为 g。

已知KNO3在20℃时的溶解度是31.6g,求此温度下将15.8g KNO3固体溶于水配成饱和溶液,需加水 克,所得溶液的溶质质量分数是 。
青海省柴达木盆地的察尔汗盐湖是我国最大的天然内陆咸水湖,当地农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。
(1)“夏天晒盐”中的“盐”其溶解度可用图中 来表示(填“a”、或“b”、或“c”)。
(2)在t1℃时,三种物质的溶解度大小关系是 。
(3)在t2℃时,将40g的a放入50g水中充分搅拌,所得溶液质量为 g。
(4)将t2℃时a、b、c的饱和溶液降温至t1℃时,溶质的质量分数由大到小的顺序为 。

如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/克 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
A.20℃时,100克水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克
C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
D.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小
KNO3和KCl在不同温度时的溶解度如下表所示:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
回答下列问题:
(1)20℃时,KCl的溶解度为 g。
(2)依据表中数据,绘制KNO3和KCl的溶解度曲线,如图中能表示KCl溶解度曲线的是 (选填“a”或“b”)。
(3)20℃时,向10g水中加入2.5g KNO3充分搅拌得到X,再加入2.5g KNO3充分搅拌得到Y,继续升温至50℃得到Z,则X、Y、Z中为饱和溶液的是 。
(4)40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃.下列说法正确的是 。
A.40℃时,硝酸钾饱和溶液中水的质量大于氯化钾饱和溶液中水的质量
B.降温至10℃时,析出的KNO3晶体质量比析出的KCl晶体质量大
C.降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数
D.当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等

根据如图所示溶解度曲线判断,下列说法正确的是( )
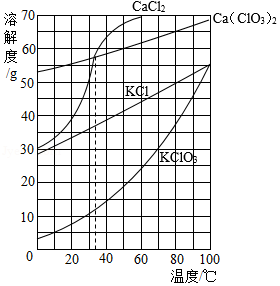
A.20℃时,将10 g KClO3加入100 g水中,溶液质量为110 g
B.30℃时,KCl饱和溶液中溶质的质量分数约为35%
C.分别将35℃的CaCl2和Ca(ClO3)2两种饱和溶液升温至40℃,CaCl2溶液中溶质的质量分数较大
D.除去CaCl2中混有的少量Ca(ClO3)2,可在较高温度配成饱和溶液,再降温结晶、过滤
溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中, 的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是 g。
(3)将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是 溶液。
(4)硝酸钾属于复合肥料,所含营养元素有 ,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量 kg。

NaCl、CaCl 2的部分溶解度数据见下表。
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 (g/100g水) |
NaCl |
36.0 |
36.6 |
37.1 |
38.0 |
39.2 |
| CaCl 2 |
27.6 |
39.8 |
41.4 |
43.2 |
45.2 |
|
①由上表可知:20℃时,NaCl的溶解度是 g/100g水;60℃时,溶解度相对较大的物质是 。
②某NaCl固体中含有CaCl 2杂质,分别取样进行实验。
【测定杂质含量】
取10.0g样品溶于水,加入足量Na 2CO 3溶液,与CaCl 2反应生成NaCl和0.01mol CaCO 3沉淀,计算样品中CaCl 2的质量。(根据化学方程式列式计算) 。
【提纯NaCl】取30g样品,依据两种物质的溶解度差异设计实验并提纯NaCl。
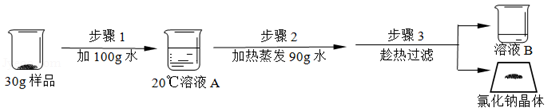
Ⅰ.溶液A是NaCl的 (选填"饱和"或"不饱和")溶液;
Ⅱ.溶液A中CaCl 2的质量分数 (选填"大于""小于"或"等于")溶液B中CaCl 2的质量分数;
Ⅲ.为达成实验目的,上述三个步骤在试剂用量、实验操作等方面都有综合考虑,请写出其设计意图 。
下表是甲和乙在不同温度时水中的溶解度,根据此表回答:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
|
| 溶解度/g |
甲 |
30 |
33 |
35 |
38 |
41 |
| 乙 |
21 |
31 |
45 |
65 |
88 |
|
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度xg。则x取值范围是 。
(4)某同学取 甲、 乙中的一种物质,按如图所示进行实验, 下列有关说法不正确的是 (填序号)。
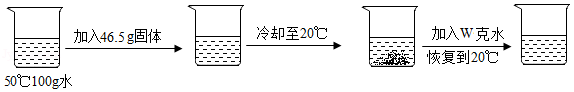
①烧杯中加入的是乙
②w取值为50
③40℃时,甲、乙的饱和溶液中溶质的质量乙>甲
④将等质量的甲、乙分别加入等质量的水中,所得溶液的溶质质量分数甲=乙
根据NaCl和KNO3的溶解度数据表,回答下列问题:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
|
(1)10℃时,NaCl的溶解度是 g;
(2)30℃时,溶解度较大的是 (选填“NaCl”或“KNO3”);
(3)下列分析正确的是 。
A.10℃时,能够配制出溶质的质量分数为20.9%的KNO3溶液
B.20℃时,20g NaCl固体加入100g水,充分溶解后得到NaCl的不饱和溶液
C.20℃到30℃之间,能配制出溶质质量分数相等的NaCl饱和溶液和KNO3饱和溶液
D.将KNO3溶液经过某种操作后,析出KNO3晶体,过滤后所得溶液溶质的质量分数与原溶液相比,可能变大、变小或不变
水是生命之源,也是实验室常用的溶剂。
(1)生活中既能降低水的硬度,又能杀菌消毒的方法是 。
(2)含氮物质进入水中会使水质恶化,这里的"氮"是指 (填序号)。
A.原子
B.分子
C.元素
(3)在某温度下,分别向盛有等质量蒸馏水的两烧杯中逐渐加入固体溶质甲和乙,图中x表示所加固体的质量,y表示溶液中溶质与水的质量比。a点对应的乙物质的溶液为 (选填"饱和"或"不饱和")溶液;该温度时甲物质的溶解度为 g。

请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在 ℃时,甲、丙两种物质的溶解度相等;
(2)在t2℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为 。
(3)若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙;
(4)t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是 。

小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
| 序号 |
温度/℃ |
水的质量/克 |
加入硝酸钾的质量/克 |
所得溶液的质量/克 |
| ① |
10 |
100 |
40 |
120.9 |
| ② |
60 |
100 |
40 |
140 |
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
4Cl溶液,经过如下操作后,得到固体。
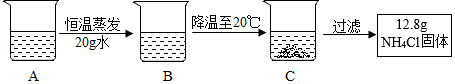
I.C中溶液的质量是 4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
4Cl固体的温度在40℃至50℃之间。
试题篮
()