如表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
| NH 4Cl溶解度/g |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
49.6 |
| NaCl溶解度/g |
35.4 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是 ;
(2)20℃时,100g水最多能溶解NaCl g;
(3)向烧杯中加入100g水和49.0g氯化铵配成50℃的溶液,此时溶液为 溶液(填"饱和"或"不饱和");再冷却到20℃,烧杯中析出固体的质量为 g。
如表是NaCl、NH4Cl在不同温度时的溶解度。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
|
(1)以上两种物质的溶解度受温度影响较大的是 。
(2)40℃时,将40.6g NaCl加入到100g水中,充分搅拌使之溶解,所得溶液的质量为 g。
(3)20℃时,NaCl饱和溶液的溶质质量分数为(精确到小数点后1位) 。
如图是对某固体物质的溶液在一定温度下,进行恒温蒸发操作的实验记录,请回答:

(1)乙中的溶液为 (填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为 。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 (填“增大”或“减小”)。
下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
溶解度/g |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
202 |
(1)影响固体物质溶解度大小的因素有 (填一种)。
(2)30℃时KNO3溶液的溶质质量分数的最大值是 (只列出表达式)。
(3)90℃时,将一定质量的KNO3溶液按图示进行操作:

90℃时的KNO3溶液是 (填“饱和”或“不饱和”)溶液。图中n的数值为 。
如表是NaCl和KNO 3在不同温度时的溶解度,回答问题
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度/g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO 3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
|
(1)两种物质中,溶解度受温度影响变化较大的是 。
(2)60℃时,按图示操作:

A中溶液是 (填"饱和"或"不饱和")溶液,C中溶液的总质量是 g。
(3)50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液 (填"大于""等于"或"小于")KNO 3溶液。
甲图是A、B、C三种固体物质的溶解度曲线。
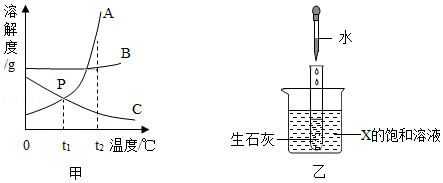
(1)甲图中,P点所表示的含义为 。
(2)t2℃时,在温度不变的情况下,将B物质的不饱和溶液转变成饱和溶液可采取的一种方法是 。
(3)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,三种溶液的溶质质量分数由大到小的顺序是 。
(4)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入一小块生石灰,再加入适量的水,烧杯中的溶液逐渐变浑浊,则X可能为 (填“A”或“B”或“C”)固体物质。
根据下表数据,回答下列问题。
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
溶解度/g |
KCl |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
54.0 |
KNO3 |
20.9 |
31.6 |
45.8 |
53.9 |
85.5 |
110 |
138 |
160 |
202 |
|
(1)KCl 和KNO3中,溶解度受温度影响较小的是 ;
(2)30℃时,KCl饱和溶液中,KCl和H2O的质量比为 ;
(3)将200g KNO 3和2g KCl的混合物,投入到100g 90℃的水中完全溶解,再降温至20℃,析出晶体的化学式为 。
已知KNO3的溶解度随温度的升高而增大。现将某温度下100克饱和KNO3溶液加热,则该溶液中溶质的质量会 。
根据如表回答问题。
| 温度(℃) |
20 |
40 |
50 |
60 |
80 |
|
| 溶解度(g/100g水) |
NaCl |
36.0 |
36.6 |
37.0 |
37.3 |
38.4 |
| NH 4Cl |
37.2 |
45.8 |
50.4 |
55.2 |
65.6 |
|
| KNO 3 |
31.6 |
63.9 |
85.5 |
110 |
169 |
①20℃时,溶解度最大的物质是
②50℃时,100g水中最多溶解NaCl g
③量筒的局部示意见图,量取水时应沿 视线(选填"a"或"b")进行读数, 视线(选填"a"或"b")对应的读数较大。
④A是80℃含有120g水的KNO 3溶液,经过如下操作,得到102gKNO 3固体。

Ⅰ.A溶液为 (选填"饱和"或"不饱和")溶液
Ⅱ.对以上过程的分析,正确的是 (选填编号)
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO 3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g。

如表是NaCl、KNO 3的部分溶解度,请回答下列问题:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
| NaCl的溶解度/g |
35.8 |
36.0 |
36.63 |
36.6 |
37.0 |
37.3 |
| KNO 3的溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
(1)NaCl、KNO 3的溶解度受温度变化影响大的是 .
(2)20℃时,氯化钠的溶解度为 ,取20g氯化钠放入50g水里,充分搅拌,可得到溶液 g.
(3)如图所示进行操作(每步均充分溶解),可得到饱和溶液的有 (填字母),溶质质量分数最大的是 (填字母).

根据表中内容回答下列问题。
温度/℃ 溶解度/g 物质 |
0 |
20 |
40 |
60 |
80 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
Ca(OH)2 |
0.173 |
0.165 |
0.121 |
0.116 |
0.094 |
(1)随温度升高,Ca(OH)2溶解度的变化趋势是 (填“增大”、“减小”或“不变”)。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 。
(3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 ;烧杯a所得溶液溶质的质量分数是 (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 。

(4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 。
如图所示为X、Y、Z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
(1)X中含有少量Y,应采用 的方法提纯X。
(2)t 2℃时,三种物质的溶解度的大小关系是 。
(3)t 3℃时,溶质质量分数为25%的X溶液降温到t 1℃,所得溶液中溶质质量分数是 。
(4)t 3℃时,等质量X、Y、Z的饱和溶液分别降温到t 1℃,溶液质量没有变化的是 。

如图是甲,乙、丙三种固体物质的溶解度曲线,据图回答下列问题:
(1)P点的含义是 。
(2)t 2℃时,把50g甲中加入到200g水中充分搅拌,静置,形成的是 溶液(填"饱和"或"不饱和")。
(3)稍微加热丙的饱和溶液即出现浑浊现象,其原因是 。
(4)除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、 、过滤、洗涤、干燥。
(5)将t 2℃时等质量的甲、乙两物质的饱和溶液分别降温至t 1℃,对所得溶液的叙述正确的是 (填字母序号)
A.溶剂质量:甲>乙 B.析出晶体质量:甲>乙
C.溶质质量分数:甲<乙
试题篮
()