水和溶液的知识在生产、生活、科研中有着广泛的应用,请你用学过的化学知识回答下列问题:
(1)生活中常用 区分硬水和软水。
(2)某同学在完成电解水实验时,发现正极产生了5mL气体,则负极产生气体的体积是 mL。
(3)爱护水资源,人人有责,你认为下列做法会造成水污染的是 。
A、生活污水直接排放 B、农业上过量的施用农药和化肥
C、工业废水直接排放 D、生活上不用含磷洗衣粉
E、不间断放水洗衣服 F、自来水生产过程中使用活性炭
(4)如图为A、B、C三种物质的溶解度曲线,据图回答:

①t1℃时,将15gA物质放入到50g水中,充分搅拌,所得溶液的质量是 g。
②t2℃时,将等质量的A、B、C三种物质的饱和溶液,降温到t1℃,所得溶液中溶剂的质量由大到小的顺序是 。
③从混有少量B物质的A溶液中提纯A物质的方法是 。
根据KNO 3和NaCl的溶解度曲线,回答下列问题:
(1)10℃时,KNO 3的溶解度为 g。
(2)有一杯接近饱和的硝酸钾溶液,要使其达到饱和的方法是 (写一种)。
(3)在t℃时,将a g KNO 3、b g NaCl分别溶解在50mL水中恰好饱和,则a b(填">"、"<"或"=")。

分析处理图表信息是学习的一种重要方法,如表是氯化钠和硝酸钾在不同温度下的溶解度。
温度/℃ |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
36.0 |
36.6 |
37.3 |
38.4 |
KNO3 |
31.6 |
63.9 |
110 |
169 |
|
这两种固体物质在水中的溶解度曲线如图所示:
请仔细阅读图表后回到下列问题:
(1)A曲线表示的是 的溶解度曲线。(填“NaCl”或“KNO3”)
(2)P点的含义是 。
(3)t2℃时,将等质量的A和B的饱和溶液降温至t1℃,所得溶液的质量分数关系是A B.(填“<”、“>”或“=”)

根据图中A,B.C三种固体的溶解度曲线回答:
(1)t1℃时,A的不饱和溶液变成饱和溶液可采用的一种方法是 ;
(2)t2℃时,A,B,C三种物质的溶解度大小关系是 ;
(3)将t2℃的A,B,C三种物质的饱和溶液降温到t1℃,不会析出晶体的是 。

根据图中A,B.C三种固体的溶解度曲线回答:
(1)t1℃时,A的不饱和溶液变成饱和溶液可采用的一种方法是 ;
(2)t2℃时,A,B,C三种物质的溶解度大小关系是 ;
(3)将t2℃的A,B,C三种物质的饱和溶液降温到t1℃,不会析出晶体的是 。

酸、碱、盐是重要的化合物,研究它们的性质有重要意义.
(1)NaCl、KNO3、NH4Cl三种固体在水中的溶解度曲线如图所示,请仔细观察曲线,回答下列问题:
①三种固体物质的溶解度受温度影响最小的是 .
②30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是 .
③图中A、B点的坐标为:A(10,21)、B(40,64).若将100g40℃的硝酸钾饱和水溶液降温到10℃,析出KNO3固体的质量为 g(保留一位小数).
(2)实验桌上有NaOH、Ba(OH)2、Na2CO3、稀硫酸四种溶液,它们只有编号却没有标签.某同学按下列步骤鉴别四种溶液.

①写出反应Ⅲ的化学方程式 .
②如图是水和NaOH水溶液中微粒的存在情况示意图,由此分析C溶液能使酚酞溶液变红的原因是 (填序号).

a.C溶液中Na+数目大于CO32﹣数目
b.C溶液中H2O数目大于OH﹣数目
c.C溶液中H2O数目大于H+数目
d.C溶液中OH﹣数目大于H+数目.

如图是甲、乙两种固体物质的溶解度曲线。请回答:
(1)图中P点表示甲的溶液是 (填“饱和”或“不饱和”)的。
(2)要将t3℃时乙的饱和溶液变为不饱和溶液,可采用的方法是 (填一种即可)。
(3)将t2℃甲的饱和溶液降温至t1℃时,所得溶液的溶质质量分数 (填“变大”,“变小”或“不变”)。

苦卤中提取氯化钾
氯化钾是低钠盐的主要添加剂,从海水晒盐后的苦卤中可以提取氯化钾。

(1)物理方法提取
苦卤的主要成分是氯化镁和氯化钠,其次是硫酸镁和氯化钾。它们的溶解度曲线如图1所示,提取过程如下:
①将苦卤在较高温度下(填操作名称) 析出氯化钠和硫酸镁。
②将①中所得混合物进行 操作得到母液。
③将母液降温,氯化钾和氯化镁析出。在较低温度下用水洗涤,即可获得较纯净的氯化钾。
(2)化学方法提纯
工业生产的氯化钾中含有少量硫酸镁杂质,不能满足科研的需要,实验室提纯过程如图2所示:

①提纯过程所用试剂X、Y分别是(写溶质化学式) 、 ,所加试剂均稍过量的目的是 。
②写出提纯过程中发生反应的化学方程式 。
③步骤Ⅲ中实际参加反应的离子有(写符号) 。
如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:

(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 。
(2)P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为 。
(3)t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,则烧杯a中溶解的物质是 (填“甲”或“乙”),所得溶液的质量为 g。
(4)当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用 (填“降温”或“蒸发”)结晶的方法提纯甲物质。
(5)下列说法正确的是 (填字母序号)。
A.将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B.将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质量分数增大
C.将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D.将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
氯化钠 溶解度/g |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠溶解度/g |
6 |
10 |
18 |
36.5 |
50 |
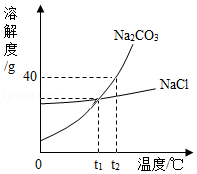
(1)t1℃时,NaCl的溶解度是 g。
(2)t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为 。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是 (填“降温结晶”或“蒸发结晶”)
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
氯化钠 溶解度/g |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠溶解度/g |
6 |
10 |
18 |
36.5 |
50 |
(1)t1℃时,NaCl的溶解度是 g。
(2)t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为 。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是 (填“降温结晶”或“蒸发结晶”)

化学是造福人类的科学,请利用所学知识回答下列问题。
(1)新型材料有着广泛的应用。
应用 |
“蛟龙”号深潜器 |
“神舟”五号宇航员航天服 |
新型水处理剂 |
用到的材料 |
特种钢 |
高强度涤纶 |
纳米铁粉 |
①上述材料中属于有机合成材料的是 。
②纳米铁粉能吸附废水中的某些污染物,被吸附后的废水经沉降、过滤可去除污染物。
下列物质也能因吸附而具有净水作用的是 (填字母)
a.生石灰 b.活性炭 c.纯碱
(2)溶液与人们的生产生活密切相关,图I为甲、乙、丙三种固体物质的溶解度曲线。
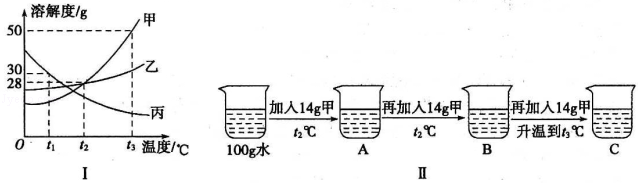
①t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是 。
②某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,其中属于饱和溶液的是 (填字母)。
③t3℃时向盛有40g甲物质的烧杯中加入50g水充分溶解后,所得溶液溶质的质量分数为 。(结果精确到0.1%)
硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 ,其溶液的溶质质量分数为 (结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法不正确的是 。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小顺序为 ;
(2)t2℃时,乙物质的溶解度为 g
(3)将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为 g,所得甲溶液溶质质量分数为 。
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。

阅读下面材料,回答问题。
人类赖以生存的环境由自然环境和社会环境组成。自然环境由生物圈、岩石圈、大气圈、水圈组成(如图1所示),四个圈层经过漫长演化,既相对稳定、动态平衡,又相互作用、不断变化,各圈层之间的物质和能量不停循环,这些循环既跟物质的组成、结构和性质有关,也受人类活动的影响,并通过复杂的物理变化和化学变化实现。
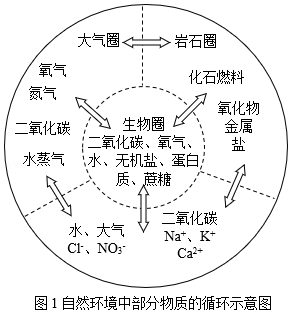
(一)内涵决定身份﹣﹣物质的组成与分类
(l)用化学符号填空:
岩石圈中含量最高的金属元素是 。大气圈中含量最高的物质是 。水圈中含量最高的元素是 。土壤中能促进农作物根系发达的元素是 。
(2)按要求填表:
物质所属圈层 |
物质名称 |
物质的化学式 |
用符号表示构成物质的微粒 |
物质类别 |
生物圈 |
蔗糖 |
|||
大气圈 |
氩气 |
|||
水圈 |
氢氧化钙 |
|||
岩石圈 |
Na+、SiO32﹣ |
(二)甲烷﹣﹣小分子,大作为
在图1的四大圈层中,有下列6种物质:①甲烷;②水;③二氧化碳;④一氧化碳;⑤氢气;⑥氧气。构成这些物质的分子虽然简单,但这些物质有的是人类赖以生存的基本物质,有的是物质循环关键物质,有的是人类社会生产活动必需的物质。请回答:
(1)在这6种物质中,元素种类共有 种,人类的生命活动不可缺少的物质有 (填化学式,下同),植物生长必需的物质有 ,元素种类完全相同的物质是 。
(2)甲烷是最重要的基础有机物之一,不仅可做燃料,还能发生如下反应:
①在隔绝空气和1000℃条件下,甲烷分解产生炭黑和氢气;
②在隔绝空气和1500℃条件下,甲烷分解产生乙炔和氢气;
③在1400℃条件下,适当比例的甲烷和氧气反应生成氢气和一氧化碳;
④在800℃和催化剂条件下,适当比例的甲烷和二氧化碳反应生成氢气和一氧化碳。
试写出上述②~④三个反应的化学方程式:
② ;
③ ;
④ ;
(3)在反应①~④中,属于置换反应的有 。
在反应①和②中,反应物相同,而生成物不同,从微观的角度看,是因为反应条件不同导致 。
③和④两个反应的反应物不同,但生成物相同,从物质组成的角度看,其原因是 。
在实际生产中,反应③需要按比例控制氧气不能超量,从物质性质的角度看,原因是 。
(三)柔之力﹣﹣神奇的水溶液
水在生活、生产和科学实验中应用广泛。岩石圈约有四分之三被水覆盖,其中的某些物质被水溶解,其随水的天然循环在水圈中富集,富集后的物质可能再次沉积到岩石圈。
图2是氯化钠和碳酸钠的溶解度曲线。据图回答下列问题:
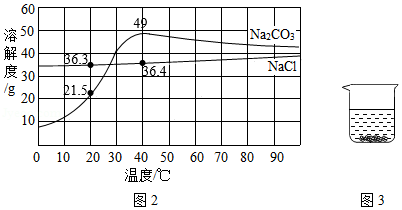
(1)青海湖区的人们有一种经验,冬天捞“碱”、夏天晒盐,这里的“碱”指纯碱,盐指氯化钠,他们所依据的原理是 。
(2)纯碱是一种重要的化工原料,但仅用物理方法从盐湖中“捞碱”远远不能满足需求,工业上主要利用从水圈中获得的食盐来制备纯碱,其反应的化学方程式是 、 。
(3)为确定某白色周体是碳酸钠还是氯化钠,在20℃时,取2.5g样品加入盛有10g水的烧杯中,充分搅拌后现象如图3所示,则固体粉末是 。若将该溶液升温到40℃时,则所得溶液溶质质量分数为 。
(四)金属﹣﹣工业的脊梁
金属及合金广泛应用于生活、生产和航天军工。
资料:水圈和岩石圈中含有丰富的镁元素。工业生产中,可用菱镁矿做原科制'备金属镁,流程如图4所示:

请回答下列问题:
(l)已知①和②属于分解反应,化学方程式分别为 和 。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备很多其他金属,请举一例说明(用化学方程式表示其制备原理) 。
(3)图5是镁原子结构示意图,镁化学性质活泼,原因是 。四大圈层中含有下列物质:①硫酸锌;②氯化钠;③硫酸;④氢氧化钙;⑤氧气。其中能和铁反应的物质有(填序号) 。
(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,瓶壁上有黑色物质生成,她认为这种黑色物质是碳单质。在上述过程中,小梅运用的科学方法有 。
试题篮
()