硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
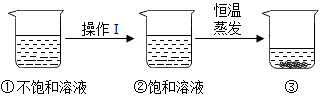
| A. |
操作Ⅰ一定是降温 |
B. |
操作Ⅰ一定是加溶质 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
如图为甲、乙两种固体物质(不考虑结晶水)的溶解度曲线,下列说法错误的是( )

A.20℃时,甲、乙具有相同的溶解度
B.甲、乙的溶解度都随温度的升高而增大
C.20℃时,可以配制溶质的质量分数为25%的甲溶液
D.50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液在先有固体出现
根据如图所示的溶解度曲线,判断下列说法正确的是( )
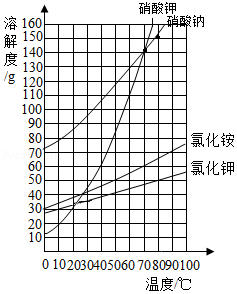
A.50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B.60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃,剩余晶体的质量氯化钾多
C.70℃时,50g硝酸钠饱和溶液与100g硝酸钾饱和溶液中所含溶剂质量之比为1:2
D.80℃时,向100g氯化钾饱和溶液中加入150g硝酸钠,充分搅拌后,最终得到250g溶液
下列说法中正确的是( )
A.凡是生成盐和水的反应都是中和反应
B.盐类物质中不一定含有金属元素
C.饱和溶液降温一定能析出晶体
D.碳酸饱和溶液的浓度比硼酸不饱和溶液的浓度大
MgSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是( )

A.N点对应的MgSO4溶液升温或降温均都可能析出晶体
B.M点对应的MgSO4溶液是不饱和溶液
C.MgSO4饱和溶液的溶质质量分数随温度升高而增大
D.40℃时,MgSO4的溶解度为41g
根据如图所示溶解度曲线判断,下列说法正确的是( )
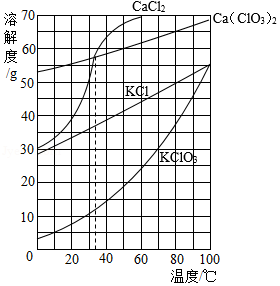
A.20℃时,将10 g KClO3加入100 g水中,溶液质量为110 g
B.30℃时,KCl饱和溶液中溶质的质量分数约为35%
C.分别将35℃的CaCl2和Ca(ClO3)2两种饱和溶液升温至40℃,CaCl2溶液中溶质的质量分数较大
D.除去CaCl2中混有的少量Ca(ClO3)2,可在较高温度配成饱和溶液,再降温结晶、过滤
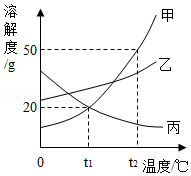
甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
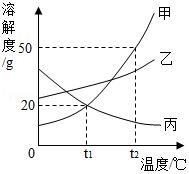
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
氯化钾(KCl)和氯酸钾(KClO3)的溶解度随温度变化曲线如图所示,下列说法正确的是 ( )

A.30℃时,KCl饱和溶液的溶质质量分数为35%
B.60℃时,a点对应KCl溶液恒温加水可变饱和
C.KCl的溶解度随温度变化的趋势比KClO3大
D.90℃150gKClO3饱和溶液降温到10℃可析出45g晶体
如图是甲,乙、丙三种固体物质的溶解度曲线,据图回答下列问题:
(1)P点的含义是 。
(2)t 2℃时,把50g甲中加入到200g水中充分搅拌,静置,形成的是 溶液(填"饱和"或"不饱和")。
(3)稍微加热丙的饱和溶液即出现浑浊现象,其原因是 。
(4)除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、 、过滤、洗涤、干燥。
(5)将t 2℃时等质量的甲、乙两物质的饱和溶液分别降温至t 1℃,对所得溶液的叙述正确的是 (填字母序号)
A.溶剂质量:甲>乙 B.析出晶体质量:甲>乙
C.溶质质量分数:甲<乙
试题篮
()