(1)多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界。
①根据下表提供的信息,填写有关含碳物质的对应特性。
| 物质用途 |
金刚石切割玻璃 |
石墨作电极 |
活性炭净水 |
| 对应特性 |
|
|
|
②下列关于二氧化碳灭火器灭火的说法正确的有 (填标号)。
A.液态二氧化碳常用于扑灭档案资料、贵重仪器、设备的失火
B.二氧化碳可覆盖在燃烧物表面,隔绝空气
C.液态二氧化碳气化时吸热,降低了可燃物的着火点
③二氧化碳是一种宝贵的资源。固定和利用二氧化碳的一个成功范例是:在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水。该反应的化学方程式为
。
④目前,人类以化石燃料为主要能源。化石燃料有煤、 和天然气,它们都属于 (选填“可再生”或“不可再生”)能源
(2)今年砷中毒事件再次进入人们的视野。砷属于 (选填“金属”或“非金属”)元素;其一种氧化物俗称砒霜,法医常用马氏试砷法来证明是否砒霜中毒,其化学原理为:+8HCl+4Zn=4ZnCl2+3H2O+2As+H2↑。请在横线上补充完整该化学方程式。
(3)溶液在工农业生产中有着广泛的用途。溶解度可表示物质溶解性的大小。


①图一是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。
| 烧杯中的溶质 |
甲 |
乙 |
丙 |
| 烧杯中固体的变化 |
|
固体逐渐减少至全部溶解 |
|
②气体的溶解度也有一定的变化规律。不同温度下,氧气的溶解度随压强的变化如上图二所示,图中t1对应的温度为40℃,则t2对应的温度 (填编号)。
A.大于40℃ B.小于40℃ C.等于40℃ D.无法确定
、请你选择“饱和、不饱和、浓、稀”等相关的词语或数字恰当地填入下列空格中。
(1)在一定温度下,把1 g熟石灰加入到100 g水中,振荡后发现有少许熟石灰未溶解。静置后取上层清液,该清液既是 溶液,也是该温度下的 溶液。
(2)已知20℃时,50 g水中最多可溶解18 g食盐。
①现向100g20℃的水中加入20g食盐,可得 g的 食盐溶液。
②若另向100g20℃的水中加入40g食盐,可得 g的 食盐溶液。
氯化钠是一种重要的资源,在海水中储量很丰富。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:
已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是 (填编号);与B溶液中溶质质量分数相等的溶液是 (填编号)。
(2)图甲、乙两种固体物质(均不含结晶水)的溶解度曲线。
①由图中可看出,甲乙两物质中,溶解度受温度影响较大的物质是 ;
②要使甲的饱和溶液变为不饱和溶液,可采取的方法是 (写出一种即可);
③t2℃时,将甲、乙各20g分别加入到两只盛有100g水的烧杯中,充分搅拌,所得乙溶液为 溶液(填“饱和”或“不饱和”);若将温度都降低到t1℃,甲溶液中溶质的质量分数 (填“>”、“<”或“=”)乙溶液中溶质的质量分数。
固体物质溶解度曲线上的任意一点表示( )
| A.溶液达到饱和状态时溶解的溶质的质量 |
| B.在一定温度和一定质量的溶剂里溶解溶质的质量 |
| C.相应温度下,100 g溶剂里能够溶解溶质的质量 |
| D.相应温度下,100 g溶剂里最多能够溶解溶质的质量 |
右图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、 乙、丙三种物质的饱和溶液(无固体存在)。 下列说法正确的是
| A.三种物质溶解度大小依次为:乙>丙>甲 |
| B.将温度由t2℃降到t1℃时,析出甲的质量比乙多 |
| C.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯 |
| D.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小 |
的顺序为:乙>丙>甲
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列相关说法正确的是( )

A.t2℃时甲和丙的溶解度都是60
B.t3℃时,甲、乙、丙三种物质的溶液中溶质质量分数一定是甲>乙>丙
C.将t3℃时甲和丙的饱和溶液降温到t2℃,两溶液的溶质质量分数相等
D.将t2℃时160g甲物质的饱和溶液降温到t1℃可析出20g固体(不含结晶水)
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
溶解度/g |
80.8 |
87.6 |
94.9 |
103 |
113 |
124 |
136 |
149 |
(1)20℃时,将90g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的质量比为 。
(2)80℃时,将249g NaNO3饱和溶液降温至 时,溶液质量变为224g。
(3)50℃时,将200g溶质质量分数为50%的NaNO3溶液改为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
甲、乙、丙三种固体物质的溶解度曲线如图所示。据图回答下列问题:
(1)t2℃时,三种物质的溶解度由小到大的顺序是 。
(2)当温度为 ℃时,甲和丙两种物质的饱和溶液中溶质质量分数相等。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)将t3℃时甲和乙的饱和溶液分别降温至t2℃,析出晶体的质量关系为 。
A.甲>乙
B.甲=乙
C.甲<乙
D.无法确定
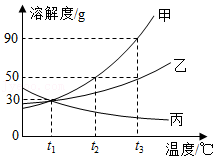
如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是( )

A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
T1℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图1、2所示。下列说法正确的是( )

A.甲中加入的固体是KNO3
B.甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液
C.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数相等
根据表中内容回答下列问题。
温度/℃ 溶解度/g 物质 |
0 |
20 |
40 |
60 |
80 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
Ca(OH)2 |
0.173 |
0.165 |
0.121 |
0.116 |
0.094 |
(1)随温度升高,Ca(OH)2溶解度的变化趋势是 (填“增大”、“减小”或“不变”)。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 。
(3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 ;烧杯a所得溶液溶质的质量分数是 (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 。

(4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 。
如图所示为甲、乙两种固体的溶解度曲线,下列说法错误的是
| A.40℃时,甲的溶解度大于乙的溶解度 |
| B.20℃时,甲、乙两种物质的溶解度相等 |
| C.甲、乙两种物质的溶解度都随温度的升高而增大 |
| D.20℃时,把30g甲物质加入100g水中,充分溶解后所得溶液为饱和溶液 |
(4 分)(1)溶解度可表示物质溶解性的大小。下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线。试回答下列问题:
① t 1℃,甲物质饱和溶液溶质质量分数 乙物质饱和溶液溶质质量分数(填“<”“=”“>”之一);
② t 1℃时,将30g乙物质放入50g水中,充分溶解后,得到溶液的质量为______________;
③ t2℃时,取甲、乙两种物质的饱和溶液,降温到t 1℃,有晶体析出的为 ,原因是_________________________________________ 。
试题篮
()