K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图:
温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
溶解度/g |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |
|
(1)图1中能表示K2CO3溶解度曲线的是 (填“甲”或“乙”)。
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为 g。
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1 w2(填“>”、“=”或“<”)。
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和溶液的方法是: 。

下表是KCl固体在不同温度时的溶解度.下列说法错误的是( )

| A. | KCl固体的溶解度随温度的升高而增大 |
| B. | 80 时, 固体的溶解度是51.1g |
| C. | 60 的 饱和溶液降温后会有晶体析出 |
| D. | 20 时, 饱和溶液的溶质质量分数为34.0% |
)1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,该技术以从海水中提取出来的食盐(NaCl)为主要原料制取纯碱,同时得到可用作化学肥料的物质氯化铵(NH 4Cl),NaCl和NH 4Cl的溶解度曲线如图2所示,请回答下列问题:

①根据图2所示,t 2℃时,NH 4Cl的溶解度是 g。
②通过NaCl的溶解度曲线,可判断出海水"晒盐"是用 的方法从海水中得到NaCl(填写"蒸发结晶""降温结晶"之一)
③t 1℃时,将不同质量的NH 4Cl饱和溶液和NaCl饱和溶液均升温至t 2℃,此时,NH 4Cl溶液的溶质质量分数 NaCl溶液的溶质质量分数(填写"大于"等于"小于""无法判断"之一)。
右图是甲、乙两种固体物质的溶解度曲线,回答下列问题:

(1)当温度为℃时,甲、乙两种物质的溶解度相等;
(2)
℃时,在100g水中加入60g甲,形成溶液(填"饱和"或"不饱和")。此时溶液中溶质的质量分数为(保留一位小数)
根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A.无法判断a中溶液是否为饱和溶液
B.c中溶液溶质的质量分数为33.3%
C.b中溶液在加热过程中始终为饱和溶液
D.常用冷却热的饱和溶液的方法获得氯化钠晶体
如图是甲、乙两种固体物质的溶解度曲线.

(1)
℃时,甲物质的溶解度为;
(2)分析
℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液是(填"饱和"或"不饱和")溶液。欲使
℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法(任填一种方法)。
我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。在制备纯碱的过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
Na2CO3 |
7 |
12.2 |
21.8 |
39.7 |
48.8 |
47.3 |
46.4 |
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
NaHCO3 |
6.9 |
8.2 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
(1)表中三种物质中,溶解性属于可溶的物质是 。
(2)在50℃时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为 ;保持烧杯中各物质质量不变,降温至40℃时,所得溶液溶质的质量分数会 (填“变小”、“不变”或“变大”)。
(3)请根据表格中数据,在如图中绘制出碳酸钠的溶解度曲线。

(4)根据溶解度曲线回答下列问题:
①60℃时,向等质量的上述四种固体物质中分别加水配成饱和溶液,所得溶液质量由大到小的顺序是 。
②侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,其化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3.请问生成的碳酸氢钠和氯化铵,哪种物质首先析出,理由是 。
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列相关说法正确的是( )

A.t2℃时甲和丙的溶解度都是60
B.t3℃时,甲、乙、丙三种物质的溶液中溶质质量分数一定是甲>乙>丙
C.将t3℃时甲和丙的饱和溶液降温到t2℃,两溶液的溶质质量分数相等
D.将t2℃时160g甲物质的饱和溶液降温到t1℃可析出20g固体(不含结晶水)
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
溶解度/g |
80.8 |
87.6 |
94.9 |
103 |
113 |
124 |
136 |
149 |
(1)20℃时,将90g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的质量比为 。
(2)80℃时,将249g NaNO3饱和溶液降温至 时,溶液质量变为224g。
(3)50℃时,将200g溶质质量分数为50%的NaNO3溶液改为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
甲、乙、丙三种固体物质的溶解度曲线如图所示。据图回答下列问题:
(1)t2℃时,三种物质的溶解度由小到大的顺序是 。
(2)当温度为 ℃时,甲和丙两种物质的饱和溶液中溶质质量分数相等。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)将t3℃时甲和乙的饱和溶液分别降温至t2℃,析出晶体的质量关系为 。
A.甲>乙
B.甲=乙
C.甲<乙
D.无法确定
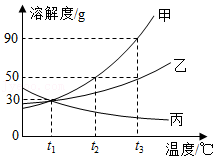
如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是( )

A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
T1℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图1、2所示。下列说法正确的是( )

A.甲中加入的固体是KNO3
B.甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液
C.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数相等
根据表中内容回答下列问题。
温度/℃ 溶解度/g 物质 |
0 |
20 |
40 |
60 |
80 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
Ca(OH)2 |
0.173 |
0.165 |
0.121 |
0.116 |
0.094 |
(1)随温度升高,Ca(OH)2溶解度的变化趋势是 (填“增大”、“减小”或“不变”)。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 。
(3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 ;烧杯a所得溶液溶质的质量分数是 (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 。

(4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 。
试题篮
()