实验室要配制100克5%的Na 2SO 4溶液。试计算:
(1)需要Na 2SO 4固体 g。
(2)Na 2SO 4中硫元素与氧元素的质量比为 。
某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液。他们的实验过程和相关数据如图所示。请计算:
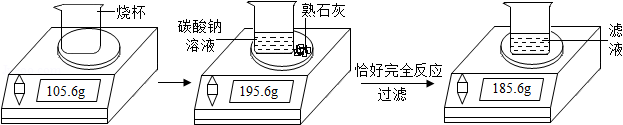
(1)实验中生成沉淀的质量为 g;
(2)所得氢氧化钠溶液中溶质的质量分数。
我市锰矿资源丰富,MnO 2是一种无机功能材料,主要用于制造干电池。某校课外活动小组同学得到当地某粗MnO 2样品(主要含有杂质MnCO 3,其它杂质忽略不计),为了测定此样品中MnO 2的含量,把100g粗MnO 2样品放入烧杯中,将40g稀硫酸分4次加入与之充分反应,测得的数据如下表。
| 次数 |
1 |
2 |
3 |
4 |
| 加入稀硫酸的质量(g) |
10 |
10 |
10 |
10 |
| 剩余固体质量(g) |
94.25 |
88.5 |
82.75 |
78.2 |
(已知烧杯中发生的反应为:MnCO 3+H 2SO 4═MnSO 4+H 2O+CO 2↑)
请根据图表数据回答下列问题:
(1)样品中杂质的质量是多少?
(2)该样品中MnO 2的质量分数是多少?
(3)稀硫酸中溶质的质量分数是多少?
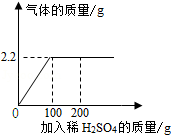
现有一包Na 2CO 3和Na 2SO 4固体粉末混合物22.2g,向其中加入足量的稀H 2SO 4,产生气体的质量和加入稀H 2SO 4的质量关系如图所示.
(1)Na 2CO 3中钠元素与氧元素的质量比为 ,产生气体的质量为 g.
(2)恰好完全反应时,求所用稀H 2SO 4中溶质的质量;
(3)求恰好完全反应是溶液中溶质的质量分数.
小芳同学采用如下方法测定石灰石中碳酸钙的质量分数:取该石灰石样品10g,把40g稀盐酸分四次加入,实验过程所得数据如表(石灰石样品中含有的二氧化硅等杂质不溶于水也不与稀盐酸反应)
| 实验次数 |
加入稀盐酸的质量/g |
剩余固体的质量/g |
| 1 |
10 |
7.5 |
| 2 |
10 |
5.0 |
| 3 |
10 |
3.2 |
| 4 |
10 |
a |
根据实验数据计算:
(1)表中a的数值为 ;
(2)样品中碳酸钙的质量分数是 ;
(3)求盐酸中溶质的质量分数。
工业盐酸中通常溶有少量的FeCl 3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl 3与NaOH反应的化学方程式为FeCl 3+3NaOH═Fe(OH) 3↓+3NaCl.请回答下列问题:
(1)FeCl 3与NaOH恰好完全反应时,生成沉淀的质量是 g。
(2)该工业盐酸中HCl的质量分数是多少?(写出计算过程)
(3)取l00g该工业盐酸稀释成HCl质量分数为10%的稀盐酸,需加多少克水?(写出计算过程)

为了测定某石灰石样品中碳酸钙的含量,小敏同学取12.5g该样品进行实验,然后将100mL稀盐酸分五次加入该样品中,充分反应后测得每次生成气体的质量如下表所示(样品中的杂质不反应,生成的气体全部逸出)。
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀盐酸的体积/mL |
20 |
20 |
20 |
20 |
20 |
| 生成气体的质量/g |
1.1 |
1.1 |
1.1 |
1.1 |
0 |
请计算:
(1)生成气体的总质量是 g。
(2)碳酸钙(CaCO 3)的化学式量是 。
(3)该石灰石样品中碳酸钙的质量分数(写出计算过程)。
我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
| 加入稀盐酸的总质量(g) |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
| 烧杯中物质的总质量(g) |
47.8 |
70.6 |
93.4 |
116.2 |
141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是 g。
(2)该贝壳样品中碳酸钙的质量分数。
硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
|
反应前 |
反应后 |
||
实验数据 |
烧杯和过氧化氢溶液的质量/g |
硫酸铜溶液的质量/g |
烧杯和烧杯中溶液的质量/g |
|
60 |
3.3 |
62.5 |
||
(1)生成氧气的质量为 g.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).
小黄同学为了测定某Cu﹣Ag合金中各金属的含量,取这种合金4.8 g与AgNO3溶液反应,加入AgNO3溶液的质量m与充分反应后所得固体的质量b的关系如图所示.请计算:
(1)AgNO3溶液中溶质的质量分数(结果精确 至0.1%);
(2)该合金中银和铜的质量比(结果精确至0.1).

某钢铁厂实验室为测定赤铁矿Fe 2O 3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 ;
(2)样品中Fe 2O 3的质量分数是 ;
(3)根据已知条件列式求解200g稀硫酸中溶质质量(x)的比例式 ;
(4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为 ;
(5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁,则理论上日产含杂质5%的生铁的质量为 .
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
工业生产常用"苛化法"制取氢氧化钠。其原料为碳酸钠、石灰乳[由Ca(OH) 2和水组成的混合物],大致流程如图1。

科学兴趣小组模拟上述流程,在实验室中制备氢氧化钠。
(1)实验室进行"操作1"时,需要用到下列器材(图2)中的 (可多选)。
(2)制备氢氧化钠的化学方程式为,Na 2CO 3+Ca(OH) 2=2NaOH+CaCO 3↓.将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳混合,若二者恰好完全反应出计算所得氢氧化钠溶液的溶质质量分数。(写出计算过程,计算结果精确到0.1%)

洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO 3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO 3反应的化学方程式:HCl+NaHCO 3=NaCl+ +CO 2↑。
(2)配制一定溶质质量分数的NaHCO 3溶液,需要用到的玻璃仪器有烧杯、滴管和 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO 3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 加入NaHCO 3溶液的质量/g |
40 |
40 |
40 |
40 |
40 |
| 反应后溶液的总质量/g |
138.9 |
177.8 |
216.7 |
255.6 |
295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO 3溶液中溶质质量是多少克?
②该品牌洁厕灵中HCl的质量分数是多少?
试题篮
()