铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g于烧杯中,然后等量分5次加入未知质量分数的某强酸(W)溶液,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
项目 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
加入W溶液的质量/g |
5 |
5 |
5 |
5 |
5 |
每次产生气体的质量/g |
0.01 |
0.01 |
0.01 |
0.005 |
0 |
(1)写出你所选择酸(W)的化学式 。
(2)铜粉中混有铁粉的质量是 。
(3)计算你选择酸(W)的质量分数(写出计算过程)。
欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

欲测定一瓶标签破损的硫酸铜溶液的溶质质量分数,现取50g硫酸铜溶液样品于烧杯中,逐滴加入10%的NaOH溶液。生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。回答下列问题:
(1)图中x= 。
(2)计算硫酸铜溶液的溶质质量分数。(写出计算过程)

常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:
| 加入稀盐酸的质量/g |
60.0 |
80.0 |
100.0 |
120.0 |
| 烧杯中溶液的pH |
13.7 |
13.3 |
7.0 |
0.7 |
(1)恰好完全反应时,消耗稀盐酸的质量为 g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
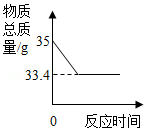
用久的热水瓶内胆有一层水垢【主要成分是CaCO3和Mg(OH)2】。兴趣小组为了解具体成分进行了实验。他们取样品25克放入质量为100克的锥形瓶中,置于电子天平上,往瓶内加入150克稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2克。请回答下列问题:
(1)恰好完全反应时,溶液中的溶质为 (填化学式)。
(2)样品中CaCO 3的质量分数是多少?
(3)反应结束时溶液中MgCl 2的质量分数是多少?(精确到0.1%)。

某同学进行硫酸铜晶体(化学式为CuSO 4•5H 2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
(1)能判断原硫酸铜溶液已饱和的方法是 。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。

下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
溶解度/克 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |

(1)10℃时,100克水中最多可溶解硝酸钾的质量为 克。
(2)20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分数为 。
(3)如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方法。(写出计算过程)
小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图象如图乙。(碱石灰能吸收二氧化碳和水) 
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到0.1%)
(2)下列情况中,会导致测得的碳酸钙质量分数偏大的是 。
①去掉装置A,将空气直接鼓入装置B
②去掉装置C,将B与D装置直接相连
③当气泡停止产生时立即停止鼓入空气
实验室用34克过氧化氢溶液和1克二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)二氧化锰作为催化剂在化学反应前后本身的 都没有发生变化。
(2)反应生成氧气的质量为 g。
(3)计算过氧化氢溶液中溶质的质量分数。(此问必须要有计算过程)
洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
[知识卡片]洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为 克。
(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程。)
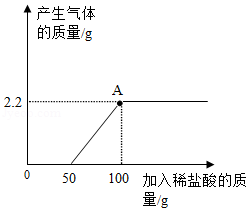
向部分变质的NaOH溶液中逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:
(1)完全反应后,产生气体的质量是 g。
(2)当滴加稀盐酸至图中A点时,溶液中含有的溶质是 。
(3)计算所加稀盐酸中溶质的质量分数。(写出规范的计算过程)。
电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO 4+2H 2O  2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
回答下列问题:
(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)
(2)向电解后得到的488.0g溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同。则这种物质可能是下列物质中的 (填选项编号)
A.Cu B.CuO C.Cu(OH) 2D.CuCO 3
某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
(1)所用硝酸银溶液的溶质质量分数;
(2)该化肥是否合格(结果精确到0.1%)。

向一定质量的酸性CuSO 4溶液(含少量H 2SO 4)中逐滴加入NaOH溶液,产生沉淀的质量与所加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液的质量为30g时,溶液中的溶质是 (化学式)。
(2)计算所加NaOH溶液的溶质质量分数。

试题篮
()