欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。
(1)某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水 g。
(2)在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是 。
(3)为测定该瓶溶液的溶质质量分数,他们取35g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
反应时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
锥形瓶+瓶内物质的总质量/g |
340.00 |
338.78 |
335.64 |
335.28 |
335.20 |
335.20 |
335.20 |
请回答:
①反应生成氧气的总质量为 g。
②该瓶过氧化氢溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)

某同学取110g K2CO3溶液于烧杯中,向其中加入CaCl2溶液。反应过程中加入CaCl2溶液与生成沉淀的质量关系如图所示。
请计算:
(1)m的值是 。
(2)恰好完全反应时,所得溶液的溶质质量分数是多少?(写出计算过程,结果精确到0.01%)

向100g溶质质量分数为8%的氢氧化钠溶液中,加入一定质量的稀硫酸至恰好完全反应,反应后所得溶液的质量为149g。求所加稀硫酸的溶质质量分数。
为测定某石灰石样品中碳酸钙的质量分数,取2.0g石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤,干燥、称重,得实验数据如表:
第一次 |
第二次 |
第三次 |
第四次 |
|
稀盐酸的用量/g |
5.0 |
5.0 |
5.0 |
5.0 |
剩余固体的质量/g |
1.5 |
1.0 |
0.5 |
0.3 |
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法正确的是( )
A.第三次实验后碳酸钙无剩余
B.第四次实验后盐酸无剩余
C.盐酸中HCl的质量分数是3.65%
D.样品中碳酸钙的质量分数是85%
向一定量的H2SO4和CuSO4的混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
(1)当加入NaOH溶液质量为ag时,溶液中含有的溶质为 。
(2)原混合溶液中,溶质H2SO4的质量(写出计算过程,下同)
(3)恰好完全反应时,消耗NaOH溶液的总质量。

某工厂废水经初步处理后可得CuSO4和H2SO4的混合溶液,华雪同学设计实验模拟后续处理过程,并得到了Cu和另一种重要化工原料绿矾(FeSO4•7H2O)。其过程如图:

(1)参加反应的CuO质量为 g。
(2)若原混合溶液质量为200g,求混合溶液中H2SO4的质量分数(写出计算过程)。
(3)若反应消耗11.2g Fe,求理论上可得到绿矾的质量(写出计算过程)。
我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如图两个实验,并对反应后试管中残留废液进行探究。
【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成 色。
【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是 。同学们对实验2反应后的废液中溶质成分进行探究。
【提出问题】废液中所含溶质是什么?
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl
猜想二:废液中的溶质可能是NaCl、Na2CO3
猜想三:废液中的溶质可能是
【设计实验】同学们为验证猜想,设计了如下实验:
方案一:
实验操作与现象 |
反应方程式 |
实验结论 |
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 |
|
猜想二正确 |
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
【进行讨论】同学们一致认为小明的实验结论不正确,理由是 。
【进行总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑 。
【拓展与应用】现有14.9克纯碱样品(含Na2CO3和NaCl的混合物),将其放入干净的烧杯中,加入89.5克水使其完全溶解,向所得溶液中缓慢加入一定溶质质量分数的稀盐酸(反应方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O)。产生气体的质量与加入稀盐酸的质量关系如图所示,试回答下列问题:
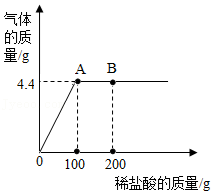
(1)产生CO2的质量为 克。
(2)所用稀盐酸中溶质的质量分数是多少? (写出具体的解题过程,下同)
(3)滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?

将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:

(1)反应生成铜的质量是 克;
(2)所加稀硫酸的溶质质量分数是 ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20克假黄金置于烧杯中,取120克稀盐酸,分6次加入,充分反应,实验数据如下:
实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
20 |
20 |
剩余固体的质量/g |
18.7 |
17.4 |
m |
14.8 |
13.5 |
13.5 |
请回答:
(1)表中m= 。
(2)假黄金(铜锌合金)中锌的质量是 g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
小华同学为测定某稀盐酸中溶质的质量分数,在烧杯里放入一定质量的大理石,然后分次加入该稀盐酸,充分反应后测得生成二氧化碳的质量如下表所示(大理石中的杂质不参与反应)。
加盐酸的次数 |
第一次 |
第二次 |
加盐酸的质量/g |
25 |
25 |
生成二氧化碳的质量/g |
2.2 |
1.1 |
(1)两次加稀盐酸后,生成二氧化碳的总质量是 g。
(2)该稀盐酸中溶质的质量分数。
曼曼称取55g氯酸钾和二氧化锰的混合物加热制取氧气,待固体质量不再改变后,她将剩余固体加入到119.2g水中,充分搅拌后过滤,得到滤渣和一不饱和溶液,再将滤渣洗涤干燥后称得其质量为6g。请计算所得溶液中溶质的质量分数。
将适量的二氧化碳通入到一定质量的氢氧化的溶液中,恰好完全反应,得到106g质量分数为10%的碳酸钠溶液。
(1)反应生成的碳酸钠质量为 g;
(2)反应前氢氧化钠溶液的溶质质量分数(写出计算过程,最终结果保留0.1%)。
工业制得的碳酸钾中常含有氯化钾。现取含氯化钾杂质的碳酸钾样品10g,其中氧元素的质量为2.4g,向该样品中加入一定量的稀盐酸,恰好完全反应时,得到47.8g溶液,请回答下列问题:
(1)写出上述反应过程中发生反应的化学方程式 。
(2)样品中氯化钾的质量为 g。
(3)求稀盐酸中溶质的质量分数(写出计算过程,计算结果保留一位小数)。
试题篮
()