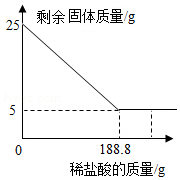
实验室常用大理石和稀盐酸制取二氧化碳。现取25g含碳酸钙的大理石于烧杯中,缓慢加入稀盐酸(大理石中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图。求:
(1)25g大理石中碳酸钙的质量。
(2)恰好完全反应时所得溶液中溶质的质量分数。
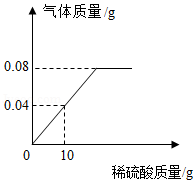
向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
次数 |
1 |
2 |
3 |
4 |
锌粉质量/g |
5 |
5 |
5 |
5 |
氢气质量/g |
0.15 |
0.15 |
0.1 |
0 |
请帮文文计算稀盐酸的溶质质量分数。
有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
加入稀盐酸的质量/g |
40 |
40 |
40 |
40 |
40 |
生成气体的总质量/g |
0.16 |
m |
0.48 |
0.5 |
0.5 |
(1)表中m的值为 。
(2)所用稀盐酸的溶质质量分数为多少?
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl3+3KOH=Al(OH)3↓+3KC1)
将20.0g铜锌合金置于烧杯中,向其中逐渐加入稀硫酸。当加入148.4g稀硫酸时,不再有气体生成,此时测得烧杯中混合物的质量为168.0g。
(1)反应中生成气体的质量是 g;
(2)求反应后烧杯溶液中溶质的质量分数。(写出计算过程)
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl 3+3KOH=Al(OH) 3↓+3KC1
向盛有Fe2O3粉末的烧杯中加入过量的稀H2SO4,充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入NaOH溶液,生成沉淀与加入NaOH溶液之间的质量关系如图所示。请回答下列问题:
(1)写出AB段内反应的化学方程式: 。
(2)加入NaOH溶液40g时溶液中存在的溶质是 (写化学式)。
(3)计算氢氧化钠溶液中溶质的质量分数。(要求写出计算过程)

某种铁合金中含有不溶于酸的杂质。取该合金样品粉末11.4克,分四次向其中加入稀硫酸共200克。反应过程的有关数据记录如下表。
次序 |
第1次 |
第2次 |
第3次 |
第4次 |
加入稀硫酸的质量/g |
50 |
50 |
50 |
50 |
剩余固体的质量/g |
8.6 |
a |
3 |
0.2 |
请回答下列问题
(1)a= 。
(2)原稀硫酸中溶质的质量分数为多少?(请写出计算过程)
某同学为定量研究氢氧化钠溶液与盐酸反应,做了如下实验:取40g氢氧化钠溶液,加入到50g溶质质量分数为7.3%的稀盐酸中,恰好完全反应。计算:
(1)氢氧化钠溶液中溶质的质量分数是 。
(2)反应后所得溶液中溶质的质量分数。(写出计算过程)
硝酸钾在不同温度下的溶解度数据如下表所示:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
| 溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
回答下列问题:
(1)20℃时,将18g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量是 g。
(2)80℃时,将269g硝酸钾饱和溶液降温到60℃,析出晶体的质量是 g。
(3)0℃时,硝酸钾饱和溶液中溶质的质量分数是 。(结果精确到0.1%)
(4)将40℃的硝酸钾饱和溶液变为不饱和溶液,可采取的措施是 。
某固体物质中可能含有NaCl、BaCl2、NaOH中的一种或几种。某校课外小组同学为了探究其成分,取该固体物质30g完全溶于水中,测得溶液的pH为7,然后将70g某稀硫酸加入该溶液中,充分反应,所加硫酸的量与产生沉淀的关系如图所示。请根据图示及相关知识回答问题。
(1)该固体物质中一定不含有的物质是 (化学式)。
(2)通过计算确定固体物质的组成成分及质量。
(3)这种稀硫酸中溶质的质量分数是多少?

为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 |
① |
② |
③ |
④ |
加入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
剩余固体的质量/g |
16 |
a |
10 |
10 |
回答列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 ,实验③所得溶液中的溶质是 (填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 |
① |
② |
③ |
④ |
加入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
剩余固体的质量/g |
16 |
a |
10 |
10 |
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
试题篮
()