请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在 ℃时,甲、丙两种物质的溶解度相等;
(2)在t2℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为 。
(3)若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙;
(4)t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是 。

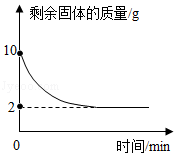
某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20g该固体混合物,向其中逐滴加入稀H2SO4,测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。回答下列问题:

(1)写出滴加稀H2SO4时发生反应的化学方程式 。
(2)该固体混合物中铜元素的质量为 。
(3)计算稀H2SO4中溶质的质量分数(写出计算过程)。
实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入192g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示。
(1)所取粉末中氧化铜的质量为 g;
(2)计算反应后所得溶液溶质质量分数。(规范写出计算过程)
用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 |
优良品 |
一级品 |
二级品 |
氯化钾质量分数(≥) |
93.00% |
90.00% |
87.00% |
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
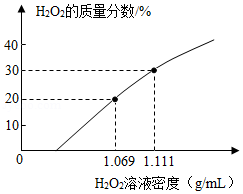
在新冠肺炎的疫情防控中,过氧化氢(H2O2)广泛用于环境消毒,在放置过程中会缓慢分解。某单位有一桶未曾使用过的久置的H2O2溶液,观测得其溶液密度为1.069g/mL,该温度下溶液的密度和溶质质量分数的对应关系如图。桶上标签提供的信息:①H2O2的质量分数为30%;②内装溶液质量50kg,完成下列问题:
(1)该久置的H2O2溶液的溶质质量分数为 。
(2)若用此久置的H2O2溶液来配制质量分数为3%的环境消毒液200kg,需用这种H2O2溶液 kg。
(3)若这桶H2O2溶液放置至完全分解,桶中剩下的液体质量是多少?(假设液体不挥发,通过计算回答,结果精确到0.1)
如图是NaCl和KNO3在不同温度下的溶解度曲线,根据曲线回答下列问题。
(1)t℃时,饱和NaCl溶液与饱和KNO3溶液的溶质质量分数 (填“相同”、“不同”或“无法确定”)。
(2)40℃时,相同质量的饱和NaCl溶液与饱和KNO3溶液均降温至20℃,析出晶体质量较多的是 。

实验室为了测定过氧化氢溶液的质量分数,称取85.00g H2O2溶液和2.00g MnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯的总质量随时间变化如表所示:
时间/S |
15 |
30 |
45 |
60 |
75 |
90 |
烧杯总质量/g |
136.5 |
136.1 |
135.70 |
135.50 |
135.40 |
135.40 |
(1)产生O2的质量为 g。
(2)过氧化氢溶液中溶质的质量分数为?(写出计算过程)
实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将140g氯化钙溶液分四次加入,充分反应,
注:发生反应的化学方程式为:CaCl2+Na2CO3 ═CaCO3↓+2NaCl
四次测量所得数据如表所示:
次数 |
累计加入氯化钙溶液的质量/g |
烧杯中溶液的总质量/g |
一 |
40 |
135 |
二 |
80 |
170 |
三 |
120 |
205 |
四 |
140 |
225 |
(1)恰好完全反应时,生成沉淀的总质量为 g。
(2)第四次测量时,所得溶液中的溶质有 (填化学式)
(3)计算氯化钙溶液的溶质质量分数(写出计算过程,计算结果保留到0.1%)
某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 氢氧化钠溶液的质量/g |
20 |
20 |
20 |
20 |
20 |
| 沉淀质量/g |
4.9 |
9.8 |
m |
19.6 |
19.6 |
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
73g盐酸与足量锌粒反应,生成的气体在标准状况下的体积为4.48L.(在标准状况下,氢气的密度为0.0899g/L)
(1)生成的气体的质量为 (结果保留1位小数)。
(2)计算盐酸中溶质的质量分数(写出计算过程)。
为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 滴入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
25 |
| 生成气体的总质量/g |
0.05 |
m |
0.15 |
0.20 |
0.20 |
请完成下列问题:
(1)表中m的值为 ;
(2)银、锌合金中银的质量分数为 ;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
下表是A、B、C三种固体物质在不同温度下(t1<t2<t3)的溶解度,请回答:
温度(℃) |
t1 |
t2 |
t3 |
物质A(克) |
36.0 |
36.2 |
37.3 |
物质B(克) |
31.6 |
36.2 |
110.0 |
物质C(克) |
0.165 |
0.135 |
0.076 |
(1) ℃时,A、B两种物质的溶解度相同。
(2)t3℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图),将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为 (选填“甲”或“乙”)。
(3)t1℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为 。

一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )

A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
试题篮
()