对知识的比较与归纳是学习化学的重要方法,现有以下三个化学方程式:
①
↑
②
↑
③
↑
通过比较发现:
(1)它们有许多相似之处,请写出其中的一条:;
(2)它们也有许多不同,请指出其中一个与另外两个的不同之处:(答一条即可)。
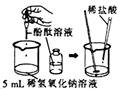
下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。

(说明:图中
、
、
、
、
、
均为溶液编号)
根据上图实验,请你与甲、乙同学一起完成下列探究:
| 探究环节 |
甲同学的探究 |
乙同学的探究 |
| 提出问题 |
溶液为什么不变红? |
溶液中溶质成分是什么?(酚酞不计) |
| 作出猜想 |
实验过程中,酚酞变质了。 |
猜想一: 猜想二: 、 |
| 实验验证 |
(1)取少量
溶液于另一试管中,向其中滴加
溶液,溶液变红,说明甲同学的猜想(填"成立"或"不成立")。 (2)你认为,在常温下 溶液测出的 应(填">"、"="或"<")7。 |
取少量
溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为。据此,你认为乙同学的猜想(填"一"或"二")成立。 |
| 交流反思 |
(1)甲、乙同学的实验中,反应均涉及到的化学方程式是。 (2) 溶液未变红,你认为原因是 溶液中较多,加入的 溶液未将其完全中和。 (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。 |
(1)下列氮肥含氮量由高到低的排列顺序是:(用序号表示)
| 常见氮肥 |
①
|
②
|
③
|
| 相对分子质量 |
80 |
79 |
60 |
(2)治理汽车尾气中的
和
的一种方法是:在汽车的排气管上装一个催化转化装置。使
和
反应生成
和
,写出该反应的化学方程式。
(3)有机物中碳氢化合物可用
表示,其完全燃烧的化学方程式:
判断等质量的①
,②
,③
,三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是 (用序号表示)。
为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;
(2)发生反应的化学方程式为;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为;
(4)该黄铜样品中铜的质量分数是;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是,再经过某些反应及操作就得到了所需铜盐。
分类、类比是学习化学常用的方法。
(1)初中化学有许多实验,若按照实验主要目的可将实验分为:探究化学反应前后物质的质量关系、探究物质的性质、探究物质的含量等。据此应将下列实验中的D与(填"A"或"B"或"C")归为一类,依据是。
 |
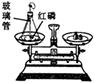 |
 |
 |
| A |
B |
C |
D |
(2)许多物质的命名与元素的化合价高低有关,如锰酸钾、高锰酸钾,其中锰元素的化合价分别为+6、+7。氯元素常见的化合价有+7、+5、+1、-1等,由此推测钠元素、氯元素和+7价氯元素三种元素组成的化合物的名称为,化学式为。
某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系如图所示。下列说法不正确的是
| A.a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ |
| B.c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ |
| C.当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ |
| D.当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等 |
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究。
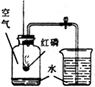
【设计方案】甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。装置A中发生反应的化学方程式为 ① ,洗气瓶B中浓硫酸的作用为 ② 
【实验探究】当玻璃管中固体由黑色转变为红色时,实验测得:①装置C的玻璃管和其中固体的总质量在反应后减少了1.6g;②装置D的干燥管和其中物质的总质量在反应后增加了1.82g,用此数据算得水中H、O元素的质量比为 ① ,而由水的化学式算得H、O元素的质量比为 ② 。
【分析交流1】针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是________________。
(假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
【意外发现】丙同学不小心将反应后的少量红色固体a洒落到多量稀硫酸中了,发现除了有红色固体b以外,溶液的颜色由无色变为蓝色。
【提出问题】铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
【查阅资料】①CuO被还原的过程中会有Cu2O生成,Cu2O也能被还原成Cu;
②Cu2O固体是红色的,它与稀硫酸的反应为:Cu2O+H2SO4=CuSO4+Cu+H2O.
【得出结论】红色固体a中含有Cu2O。
【分析交流2】红色固体a中含 有Cu2O是否会影响水组成的测定结果 (填“影响”或“不影响”)。
【提出猜想】针对红色固体a的成分,小组同学提出猜想①是:Cu2O;
猜想②是:________________。
【拓展探究】丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量 的质量。
【教师点拨】称取一定质量的红色固体a与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
【定量分析】小组同学再次实验,他们开始称取质量为3.6g的红色固体a,与足量的稀硫酸完全反应后得到红色固体b为2g请通过计算说明,哪个猜想成立。
某工厂综合加工海水的主要步骤如图所示.
请根据图示回答下列问题:
(1)操作I的名称是_______________。
(2)试剂1是___________________(写化学式,下同),白色沉淀D是____________。
(3)溶液B中含有的溶质是__________________________。向溶液B加入试剂2后,在溶液中可观察到_______________________________的现象。
(4)在熔融状态下电解无水氯化镁会产生一种金属单质和一种双原子分子的气体单质,该反应的化学方程式是__________________________________________________。
氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等。某校化学研究小组用镁与氮气反应制备氮化镁(Mg3N2),并用实验方法测定氮化镁的纯度。
I.制备氮化镁
【查阅资料】
①(NH4)2SO4+2NaNO2 2N2↑+Na2SO4+4H2O,该反应为放热反应。
2N2↑+Na2SO4+4H2O,该反应为放热反应。
②饱和硫酸亚铁溶液能吸收氧气;稀硫酸能吸收氨气。
③在常温下或温度不高的条件下镁几乎与水不反应。
【实验】
制备氮化镁的装置示意图如下:
(1)D装置的作用是 ,G装置的作用是 。
(2)E装置中发生反应的化学方程式为 。
(3)实验时先进行 (选填“A”或“E”)处加热,理由是 。
II.测定氮化镁的含量
氮化镁是浅黄色粉末,极易与水反应生成Mg(OH)2沉淀和NH3,反应的化学方程式为 ,氮化镁(Mg3N2)中氮元素的化合价是 。
【定性分析】
步骤一:取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成。
步骤二:弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡。该步骤中产生气泡的化学方程式为 。
【定量测定】
按下图实验装置进行实验:
(4)取氮化镁样品16g进行实验,I装置增重3.4g,求该样品中氮化镁的质量分数(请写出计算过程)。
(5)球形干燥管的作用是 。
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH 7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为 。
(3)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是 (填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
某学生为了验证锌、铁、铜三种金属的活动性顺序,设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中;②将Zn、Cu分别加入到ZnSO4溶液中;③将Zn分别加入到FeSO4、CuSO4溶液中;④将Fe分别加入到ZnSO4、CuSO4溶液。其可行的是
| A.①或② | B.①或④ | C.②或③ | D.③或④ |
下列关于化学反应A+B→C+D的叙述,正确的是
A.该反应一定属于置换反应或复分解反应
B.A、B的相对分子质量之和,一定等于C、D的相对分子质量之和
C.若C为水,则A、B中至少有一种物质为酸或碱
D.A为酸,则C、D一定有一种物质为盐
宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。微观思维是化学思维的重要组成部分。已知某反应的微观示意图如下所示,下列说法错误的是
| A.甲和乙两种物质参加反应的分子个数比为1:1 |
| B.化学反应前后原子个数没有改变 |
| C.该反应属于氧化反应 |
| D.丙物质中所含碳、氧元素的质量比为3:8 |
在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法正确的是
| A.该反应为分解反应 |
| B.丙可能是单质 |
| C.丁是该反应的催化剂 |
| D.该反应中乙和丙两种物质变化的质量比为3:17 |
一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应, 测得反应前后各物质的质量分数如图所示,下列说法正确的是
| A.该反应的基本反应类型是分解反应 |
| B.丁是该反应的催化剂 |
| C.该反应中乙、丙的质量比为7 : 17 |
| D.该反应中甲、丙的质量比为14 :17 |
试题篮
()