某化学兴趣小组的同学探究酸碱中和反应实验:
(1)配制76g质量分数为10%的稀盐酸,需要 g质量分数为38%的盐酸,需要 mL水。
(2)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞试液, 溶液变成 色,pH 7(填“>”、“<”或“=”),向锥形瓶逐滴滴入(1)配制的稀盐酸并振荡,至溶液恰好褪成无色。写出反应的化学方程式 。此反应属于中和反应,请用文字叙述一例中和反应在日常生活或工农业生产中的应用
溶液变成 色,pH 7(填“>”、“<”或“=”),向锥形瓶逐滴滴入(1)配制的稀盐酸并振荡,至溶液恰好褪成无色。写出反应的化学方程式 。此反应属于中和反应,请用文字叙述一例中和反应在日常生活或工农业生产中的应用  。
。
20℃时氯化钠的溶解度为36克。该温度下,某氯化钠溶液的组成模型如图,请你回答: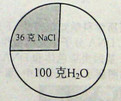
(1)该溶液的溶质是
(2)保持温度不变蒸发10克水后,氯化钠溶液的溶质质量分数 。(填“变大”、“变小”、“不变”)
无土栽培是利用营养液栽培作物的一种方法。
(1)下列化学肥料中属于复合肥的是 (填序号)。
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为
g。
(3)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。
实验1 实验2
根据以上实验,请你进行有关推断。
①由实验1可确定原营养液中一定没有的物质是 ;
②根据实验1、实验2推测原营养液的组成可能有 种情况;
③若测得原营养液中K+和Cl一的数目之比为1:1,则原营养液的组成中的溶质是
课堂上老师做了一个实验:将液态空气倒入一只烧杯中,发现立即冒出大量气泡,把一根燃着的小木条置于烧杯口,小木条火焰熄灭;过一会儿再把燃着的小木条置于烧杯口,此时小木条不但没有熄灭,反而燃烧更旺。据此实验现象回答下列问题:
(1)由于液氮的沸点比液氧的沸点 (选填“高”或“低”)导致 首先从液态空气中蒸发出来。
(2)“过一会儿,小木条不但没有熄灭,反而燃烧更旺”,其原因是 。
六种物质:氧气、氮气、二氧化碳、氦气、水蒸气、氢气。其中:
(1)可用于医疗急救的是 ;
(2)属于稀有气体的是____ ____;
(3)薯片放在空气中一段时间就不脆了说明空气中含有__________;
(4)在空气中含量最多且化学性质比较稳定的是__ _______;
(5)最理想的燃料是_______ _____;
(6)参与绿色植物光合作用的是 。
氢气、氧气、氮气、二氧化碳四种气体中,占空气体积分数最大的是(填化学式,以下相同) ;能使带火星木条复燃的是 ;能与氧化铁在一定条件下发生置换反应的是 ;能使紫色石蕊试液变红色的是 ;能使澄清石灰水变浑浊的是 。
实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题。
(1)写出实验室制取氧气的一个化学方程式____________。利用该反应制取氧气,发生装置应选____________(填序号,下同)。
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2==2NO2,则收集一氧化氮气体时不能用的装置是(填序号)____________。
(3)按图F作细铁丝在氧气中燃烧的实验,我观察到的现象有____________(只答一条),其相关的化学方程式是____________。
(4)实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是____________。
实验室常用下列装置来制取氧气:
(1)写出图中有标号仪器的名称:a 、b ;
(2)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号),其中二氧化锰起 作用。
(3)用高锰酸钾制取氧气时,发生反应的化学方程式为 。
(4)用E装置收集氧气的依据是 ,检验氧气是否集满的方法是 。
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激
性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。
制取氨气反应的方程式2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2X。
CaCl2 + 2NH3↑+ 2X。
X的化学式为: 。
②制取并收集NH3,应该从上图中选择的发生装置是 ___ ,收集装置是_________。
③NH3是一种碱性气体,干燥时不能选用下列干燥剂中的 (填序号)。
A.固体氢氧化钠 B.浓硫酸 C.生石灰
(10内江1)采集空气样品时,如果没有专业仪器,我们可用矿泉水瓶装满水到采样地点倒掉,这种收集气体的方法叫做________;实验室制氧气时,也可用这种方法收集,用该方法收集氧气时,制备氧气装置内空气配排尽的标志是________________。
请根据下列装置图,回答有关问题
(1)写出实验室在B装置中用H2O2制取氧气的化学方程式:
。
(2)实验室收集氧气可用 (填编号)装置,在收集过程中,当氧气充满集气瓶后,将导管从瓶口处移开, 在桌上。
(3)用A装置制取氧气时,试管内的棉花没有发生燃烧,从根据燃烧的投机倒把分析 ,主要原因是 。
以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶 液浓度% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
30 |
5 |
35 |
|
2 |
49.21 |
| ④ |
30 |
5 |
55 |
|
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;
从实验 和 对比可知,化学反应速率与温度的关系是:
;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率
有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生
氧气的总重量 (选填“减小”或“不变”或“增大”)。
下图是实验室用于制取、干燥和收集气体的装置图,实验课上同学们用过氧化氢溶液和二氧化锰制取并收集氧气,请回答问题:
(1)制取氧气的发生装置应选择(填装置编号) 。
(2)现要收集一瓶干燥的氧气,请按气体的流向,用装置导管的编号将装置连接好:①→ 。
(3)收集一瓶氧气,燃烧匙里放少量硫粉,加热直至燃烧,把燃烧匙伸进盛满氧气的集气瓶里,可观察到硫在氧气里剧烈燃烧,发出 火焰。
实验室通常采用加热氯酸钾与二氧化锰的混合物制取
氧气,写出该化学反应方程式 ,其中二氧化锰是 剂。
如图是实验室用高锰酸钾制取并收集氧气的装置。
(1)写出图中仪器a的名称 ▲ 。
(2)用高锰酸钾制取氧气时,用一团棉花放在试管口的主要作用是 ▲ 。
用下图A所示装置测定空气中氧气的含量。
(1)实验时,取下橡胶塞,点燃红磷迅速伸入集气瓶中并塞紧橡胶塞,这时看到的现象是 。
(2)小倩设计了如下图B所示的改进装置,其优点是不污染空气或操作简便或实验误差较小(只写一点)。从理论上分析,玻璃管内液面最终将上升至 处(填1、2、3、4),但实验测结果液面往往偏低,其原因可能是 (其他合理答案均可)。(只写一条)
试题篮
()