某兴趣小组同学对实验室制备氧气的条件进行如下探究。
【提出问题】①氧化铜是否也能做氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
【查阅资料】研究表明,许多金属氧化物对氯酸钾的分解有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如下表所示:

实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是 。
【设计并完成实验】Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将X g氯酸钾与1.0g氧化铜均匀混合加热
【实验现象分析】Ⅲ中X的值应为 ,实验Ⅰ和Ⅲ比较可证明 。将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和Xg氯酸钾混合加热,现象与实验Ⅲ相同,这些步骤是为了证明氧化铜在该化学反应前后 和 都不变。
【结论】氧化铜也能作氯酸钾分解的催化剂,实验Ⅲ中的化学反应的符号表达式为 。
【实验反思】实验Ⅱ和Ⅲ对比的目的是 。
【提出问题】②MnO2的用量对 H2O2分解反应有何影响?

【设计并完成实验】利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中为3%H2O2溶液,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计。)
【讨论交流】(1)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出 。
(2)当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线。曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求。在此实验条件下,若MnO2的质量有4克(一药匙),就能使下图 (填字母)烧杯中所装的3%H2O2溶液,其分解速度最接近实验要求。

图A所示是用红磷在空气中燃烧的方法测定空气中氧气含量。(在集气瓶中装入少许水,会使生成的五氧化二磷烟状物迅速溶解)。
(1)实验原理:
①磷在空气中燃烧反应的化学方程式 。
②密闭的装置内,由于 被消耗,生成固体物质,该装置内气体压强 。
(2)实验探究:
第一步:集气瓶装入少许水,然后将集气瓶空的容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
(3)实验结论: ①空气中氧气约占空气总体积的 。
②该实验证明了氧气具有 的性质;同时也证明了氮气有哪些性质? (写一点)
(4)反思与评价:①实验完毕,若进入集气瓶中水的体积不到总容积的1/ 5,你认为导致这一结果的原因可能是 。(讲一点)
②某同学对实验进行反思后,提出了改进方法(如图B所示),你认为改进后的优点是: 。
(5)拓展迁移:
已知:镁在氧气中燃烧生成氧化镁,镁在氮气中燃烧生成氮化镁(固体),能否用镁代替红磷测定空气中氧气的含量?并简要说明理由。
答: 填“能”或“不能”),理由 。
某校化学兴趣小组就空气中氧气的含量进行实验探究:
[集体讨论](1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择
A.蜡烛 B.红磷 C.木炭
为了充分消耗容器中的氧气,药品的用量应保证 .写出红磷燃烧的文字表达式
(2)小组同学共同设计了如图所示的两套装置,
你认为合理的是(填编号) .
为了确保实验的成功,在装药品之前应该 .
[分组实验]在讨论的基础上,他们分组进行了实验.
[数据分析]实验结束后,整理数据如下:(注:集气瓶容积为100 mL)
| 组 别 |
1 |
2 |
3 |
4 |
5 |
6 |
| 进入集气瓶中水的体积(mL) |
20 |
21 |
19 |
20 |
22 |
18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的 .
通过实验还可以推断集气瓶中剩余气体的物理性质是 、化学性质是 .
[实验拓展](4)已知镁在空气中燃烧可分别与氧气和氮气反应,都生成固体物质,此实验中镁 (填“能”或“不能”)代替红磷,其原因是 .
用来测定空气成分的方法很多,如图所示是小明用红磷在空气中燃烧的测定方法。实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸
入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
(1)上面的实验同时证明了氮气有 的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是 。(至少二点)
(3)某同学选用木炭代替红磷进行实验,是否可行?为什么?
向盛有氢氧化钠溶液的烧杯中滴加稀盐酸,搅拌后没有观察到明显现象.教材上借助酸碱指示剂验证了该反应的发生.是否还有其他方法判断该反应的发生呢?小明和小亮两位同学分别进行了实验探究.
【实验探究一】小明同学取上述反应后的溶液少许于试管中,向其中滴加硝酸银溶液,观察到有白色沉淀生成,再滴加足量的稀硝酸,沉淀不溶解.小明认为白色沉淀是NaCl与AgNO 3反应生成的,于是得出氢氧化钠与盐酸发生了反应的结论.
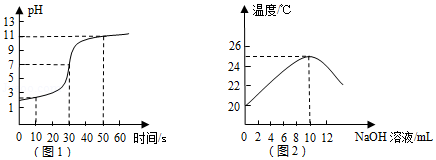
【实验探究二】小亮同学取一定量的稀盐酸于烧杯中,向其中逐滴加入氢氧化钠溶液,搅拌并用pH计精确测量烧杯中溶液的pH,绘制溶液的pH随时间变化的曲线如图1所示.小亮根据溶液pH的变化,推断盐酸与氢氧化钠发生了反应.
【讨论交流】(1)针对两位同学的实验探究,老师认为小明同学的结论是错误的,理由是 (用化学方程式表示).
(2)在小亮的实验中,当实验进行到10秒时,溶液中含有的溶质是 (填化学式),该溶液能与下列物质发生反应的是 (填序号).
①碳酸钠②氧化铜③硫酸铜 ④镁
(3)从图1的曲线中得知,当实验进行到 秒时,酸与碱恰好完全反应.
【拓展延伸】老师将氢氧化钠溶液逐滴加入到盛有稀盐酸的烧杯中,测定溶液的温度,绘制出溶液的温度随氢氧化钠溶液体积的变化而变化的曲线如图2所示,从能量变化的角度看,该反应属于 反应(填"吸热"、"放热").
【反思评价】有的中和反应没有明显现象,有的中和反应有沉淀生成或固体物质溶解的现象.请写出一个有沉淀生成的中和反应的化学方程式 .
已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
⑴该实验中红磷须稍过量,目的是 。
⑵待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶,瓶内水量约是集气瓶体积的 ,由本实验还可以推知氮气的哪一性质?试写出其中一种 。
⑶若将红磷换成炭粉,该实验能否获得成功? ,理由是 。
为探究空气的组成,小明用下图A所示装置进行实验。
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是:_______________,该反应的符号表达式为_____________。
(2)小明又设计了如上图B所示的改进装置,其优点是:___(只需写一点)。从理论上分析,玻璃管内液面最终将上升至__处(填“1”、“2”、“3”、“4”),但实测结果液面往往偏低,其原因可能是:_______(只需写一条)。
(3)从课本镁条燃烧实验小明得到启发,于是他用镁代替红磷做起了这个实验,实验完毕,冷却后进入集气瓶中水的体积远大于总容积的1/5,若装置气密性良好,则可能原因是: _ 。
学习了MnO2对过氧化氢有催化作用的知识后。某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了如下探究。
【猜想】Ⅰ. CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后_________ _____________________。
【实验】用天平称量0.2gCuO,取5ml5%的过氧化氢溶液于试管中,进行如下实验:
(1)填写下表:
| 步骤③现象 |
步骤⑥结果 |
步骤⑦现象 |
结论 |
| ___ _____带火星的木条复燃 |
____ _____ |
溶液中有气泡放出 _____ _______ |
猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的________ ____________。
(3)步骤④需用到的实验仪器有:铁甲台(带铁圈)、漏斗、烧杯、_____ ____。
(4)过氧化氢能被CuO催化分解放出O2的化学方程式为___________________。
【拓展】要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是______________
_____ __________________(写一种)。
小丽通过阅读说明书了解到家用制氧机的工作原理如下:加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气。减压时,分子筛将所吸附的氮气排放。整个过程中,分子筛并不消耗。

小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气。
【实验记录】
| 实验步骤 |
实验现象 |
化学方程式 |
| 取一只250 mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 |
木炭燃烧得更旺 |
化学方程式I |
表中,化学方程式I是 。
【实验结论】收集的气体是纯净的氧气。
【实验反思】老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气。该实验不能证明所收集气体为纯净氧气的原因是 。
实验II:测定小丽所带气体中氧气的含量。
同学们在老师的指导下用250 mL 集气瓶设计了如下图所示装置,进行实验,并重复多次。

【实验记录 】
| 实验操作 |
主要实验现象 |
实验结论及解释 |
|
| ① |
检查装置的气密性 |
|
装置的气密性良好 |
| ② |
加入药品,瓶装满水,将装置连接固定 |
|
|
| ③ |
打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b |
A中水进入到B中,B中水的体积为200 mL。 |
收集200 mL气体(由压强差引起的误差忽略不计) |
| ④ |
用凸透镜聚光引燃白磷 |
燃烧,产生大量白烟 |
|
| ⑤ |
待白磷熄灭并冷却到室温,操作I |
现象I |
小丽收集的气体不是纯净的氧气 |
表中,操作I是 。现象I是 。
上述反应化学表达式是 。
【数据记录】
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
| B中剩余水体积/mL |
100 |
42 |
39 |
41 |
38 |
【数据处理】已知,在上表数据中,第1组数据偏差较大,存在明显误差,在数据处理时应删去。取余下四次平均值计算,小丽所带气体中氧气的体积分数为 % 。
【实验反思】
(1)这台制氧机制氧气的过程发生的变化属于 (填“物理变化”或“化学变化”)。
(2)导致第1组数据产生较大误差的可能原因是 。
某学习小组对粗盐中杂质(难溶性和可溶性)的去除展开相关探究.
(1)粗盐中难溶性杂质去除的实验步骤为①溶解,②过滤,③ (写操作名称),④计算产率.
(2)步骤②中需要用到的玻璃仪器有:玻璃棒、烧杯、 (写仪器名称),其中玻璃棒的作用是 .
(3)【提出猜想】
甲同学:该粗盐中含有难溶性杂质外,是否还含有可溶性杂质?
(4)【查阅资料】]
①粗盐中可能含有镁盐(Mg 2+)和硫酸盐(SO 4 2 ﹣)等可溶性杂质.
②一些物质的溶解性表
| 阳离子 阴离子 |
OH ﹣ |
CL ﹣ |
SO |
CO |
| Na + |
溶 |
溶 |
溶 |
溶 |
| Ba 2+ |
溶 |
溶 |
不 |
不 |
| Mg 2+ |
不 |
溶 |
溶 |
不 |
说明:"溶"表示该物质可溶于水,"不"表示该物质不溶于水.
③Mg(OH) 2为白色物质,不溶于氢氧化钠溶液;BaSO 4为白色物质,不溶于盐酸;
MgCO 3,BaCO 3为白色物质都能溶于盐酸.
(5)【实验设计】
①取少量除去难溶性杂质后的盐,溶于水配成溶液.
②取少量所配溶液于试管中,滴加氢氧化钠溶液,产生白色沉淀,继续滴加氢氧化钠溶液,沉淀不溶,说明该盐含有可溶性的 盐.
③另取少量所配溶液于试管中,滴加氯化钡溶液,产生白色沉淀,再加稀盐酸,沉淀不溶,说明该盐含有可溶性的 盐.
(6)【实验结论】该盐含有可溶性杂质 .
(7)【实验拓展】以下为乙同学设计的去除食盐中可溶性杂质的试验流程:

①该实验过程中,除杂试剂都要过量,原因是 .
②过量Na 2CO 3溶液用来除 离子(填离子序号).
某学习小组对酸与碱发生中和反应进行探究,请你参与实验。
实验活动一:用酸碱指示剂探究酸与碱反应的过程。
【实验1】小组同学设计并进行如下实验。
| 实验编号 |
实验方法与操作 |
实验现象 |
解释与结论 |
| ① |
取3mL溶质质量分数为4%的NaOH溶液于试管中,滴1、2滴酚酞溶液 |
|
加入稀盐酸后,NaOH溶液中 (填离子符号)浓度减小,进而证明酸与碱能发生反应。 |
| ② |
向上述溶液逐渐滴入稀盐酸,振荡 |
溶液刚好褪色 |
|
| ③ |
向上述刚好褪色的溶液中再滴2滴溶质质量分数为4%的NaOH溶液,振荡后,再次滴入微量稀盐酸,振荡 |
|
(1)配制50g溶质质量分数为4%的NaOH溶液,所需水的质量是 g。
(2)向上述刚好褪色的溶液中加入 (填字母序号)也能达到实验目的。
A.MgCl 2溶液
B.稀H 2SO 4
C.AgNO 3溶液
D.Ba(OH) 2溶液
实验活动二:用变色硅胶验证酸与碱反应生成了水。
【查阅资料】Ⅰ.变色硅胶吸水后由蓝色变为红色。
Ⅱ.无水醋酸与氢氧化钠反应生成醋酸钠和水。
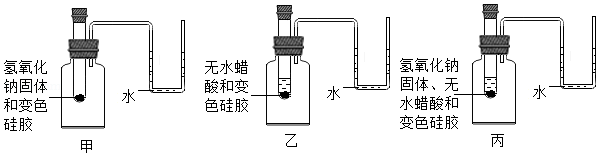
【实验2】小组同学在老师的指导下,进行如图所示的三个实验。
【讨论与交流】
(3)证明无水醋酸与氢氧化钠反应有水生成的现象是 。小芳认为【实验2】不严密,还应补充的实验是 。
(4)实验过程中,观察到丙的U形管内液面左低右高,出现该现象的原因可能是无水醋酸与氢氧化钠反应时放热或 。
咸宁市市某校2018年实验操作模拟考试的一个考题是:用碳酸钠溶液鉴别稀盐酸、食盐水和澄清石灰水。
【进行实验】
| 实验步骤 |
实验现象 |
实验结论 |
| 分别用a,b,c三支试管取样,各加入一定量碳酸钠溶液 |
a中有气泡产生 |
a中物质是稀盐酸 |
| b中无明显现象 |
b中物质是食盐水 |
|
| c中 |
c中物质是澄清石灰水 |
写出a试管中发生反应的化学方程式 。
把c试管反应后的物质进行过滤,得到滤液。
【提出问题】滤液中溶质的成分是什么?
猜想一:Na 2CO 3和NaOH;猜想二:NaOH;猜想三: 。
提示:Ca(OH) 2微溶于水。
【实验过程】为证明猜想一是否正确,进行了如下实验
| 实验步骤 |
实验现象 |
实验结论 |
| 取一定量滤液于试管中,加入一种盐溶液(写物质化学式) |
有白色沉淀 |
猜想一正确 |
写出上述有白色沉淀生成的化学方程式 。
同学们还对a试管反应后废液的酸碱性感兴趣,决定用pH试纸测定其pH值。
| 用pH试纸测定a试管反应后废液碱性的过程 |
测定结果 |
| 在白瓷板上放一小片pH试纸,用玻璃棒蘸取 。 |
pH<7(废液显酸性) |
【反思与交流】a试管中的废液显酸性,从环保、经济、操作简便等方面考虑,应向废液加入(写化学式) 后再排放。
小明参观某养鱼池时,好奇地发现农民向养鱼池撒一种叫做过氧化钙的淡黄色
固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
【提出问题】过氧化钙可否用于制取氧气?
【查阅材料】部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,可做增氧剂、杀菌剂等。
【猜想与验证】
小明依据上述材料,提出猜想Ⅰ: ,然后进行以下实验:
| 实验装置 |
实验主要过程 |
 |
检验装置气密性。 加入过氧化钙于试管中,加热,导管口有大量气泡冒出。 收集满一瓶气体。 ④ 停止加热。熄灭酒精灯前,应___________________。 ⑤ 检验气体。方法是______________________。 |
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
猜想Ⅱ:过氧化钙与水反应可制取氧气
 |
检验装置气密性。 ② 加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几 乎收集不到气体。该装置放置到第二天,集气瓶只收集到极少量 气体,振荡试管后仍有少量细小气泡缓慢放出。 |
【实验结论】不能用过氧化钙与水反应制取氧气。
【分析与反思】
①虽然没有快速收集到大量氧气,但由此实验现象,小明认为农民用过氧化钙做增氧剂的主要原因是________________________。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?你的合理建议:
_________________________。
以上建议是否可行,还需进一步通过实验验证。
小雨同学阅读课外资料得知,双氧水分解除了二氧化锰作催化剂,还可以用氧化铜等物 质作催化剂,于是她对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验:(其他可能影响 实验的因素均忽略)
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
|
|
| ② |
1.2g |
CuO 0.5g |
|
| ③ |
1.2g |
MnO2 0.5g |
|
(1)上述实验测量的“待测数据”是 。
(2)若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(3)对实验②反应后的固体加水溶解、过滤、洗涤、干燥,称量得到0.5g黑色粉末,经进一步实验证实过滤所得的黑色固体粉末为氧化铜。
【预期结论】氧化铜还能作氯酸钾分解的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是 。
【实验拓展】小雨同学从课外资料上还获得下列信息:氧化铁、硫酸铜、猪肝、马铃薯等也可以作过氧化氢分解的催化剂。下列有关催化剂的说法正确的是 。
A.二氧化锰一定是催化剂
B.同一个反应可能有多种催化剂
C.催化剂一定是加快反应速率
D.也存在减慢反应速率的催化剂
E.对一定量的反应物来说,催化剂能改变生成物的质量
小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂.于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣.
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验.
| 序号 |
KClO3的质量 |
其他物质的质量 |
温度 |
氧气的体积 |
反应所需时间 |
| ① |
2.0g |
|
330℃ |
100mL |
t1 |
| ② |
2.0g |
CuO 0.5g |
330℃ |
100mL |
t2 |
| ③ |
2.0g |
MnO2 0.5g |
330℃ |
100mL |
t3 |
| ④ |
2.0g |
MnO2 _________ g |
380℃ |
100mL |
t4 |
(1)若t1 _________ t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率.若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的 _________ 和 _________ 不变.
(2)你认为小雨设计实验③和实验②对比的目的是 _________ .
(3)实验④中MnO2的质量为 _________ g,若t3>t4,则化学反应快慢与温度的关系是 _________ .
(4)写出实验④所涉及的化学方程式 _________ .
试题篮
()