化学教材 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】(1)氧化铁能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
【实验探究】
| 实验步骤 |
实验现象 |
| ①分别量取5 mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 |
A试管中产生大量气泡,带火星木条复燃,B试管中的现象 |
| ②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象。 |
试管中均产生大量气泡,带火星木条均复燃 |
| ③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 |
|
| ④分别量取5 mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 |
  |
(1)A中产生的气体是 ;B试管中的现象 。
(2)实验②、③证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式 。
(4)实验设计④的目的是 ,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
甲同学误把H2O2溶液当作酸与Fe2O3粉末混合,发现有大量气泡产生。他联想到MnO2可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二 在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明 ;
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g。说明 ;
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。探究 。
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论? 。
用足量等体积H2O2溶液制取相同体积O2所需的时间:
实验室有一瓶黑色粉末和一瓶标签已被腐蚀的无色液体(如图)。
将二者混合会产生无色气体。为了确定它们的成分,
甲、乙两位同学进行了探究。
【猜想1】甲同学认为无色气体是氧气,其理由是(用化学方程式表示):
。
乙同学认为单从产生无色气体不能确定一定是氧气,需要进一步进行实验,请你设计实验进行验证无色气体是氧气。
| 实 验 步 骤 |
实 验 现 象 |
实 验 结 论 |
| |
|
无色气体是氧气。 |
如果实验验证了无色气体是氧气,那么黑色粉末在反应中起 作用。
【猜想2】乙同学认为无色气体不一定是氧气,可能是其他气体,其理由是(用化学方程式表示) 。
乙同学按自己的设想进行实验:取一定量的黑色粉末于试管中,加入过量的无色液体,当反应结束后,发现试管底部仍有黑色粉末。为确定此成分,请你设计实验进行验证:
| 实 验 步 骤 |
实 验 现 象 |
实 验 结 论 |
| |
|
|
| 1.将试管中的物质过滤、洗涤、干燥。 2.点燃黑色粉末,在火焰上方罩一个涂有 的小烧杯。 |
|
试管中剩余的黑色粉末可能是 。 |
学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如Al2O3是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
【提出问题】Al2O3是否可以作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3可能可以作过氧化氢分解的催化剂。
【实验验证】
| |
实验步骤 |
实验现象 |
实验结论 |
| 实验一 |
|
有少量气泡 木条不复燃 |
常温下过氧化氢溶液分解速率很慢 |
| 实验二 |
在装有过氧化氢溶液的试管中加入少量 Al2O3,然后将带火星的木条伸入试管中 |
产生大量的气泡 木条复燃 |
|
【得出结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验三:
实验三:【实验目的】探究
【实验步骤】①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量;④对比反应前后Al2O3的质量。
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究 。通过补充实验,证明Al2O3能作过氧化氢分解的催化剂,请你写出实验二中的化学反应方程式 。
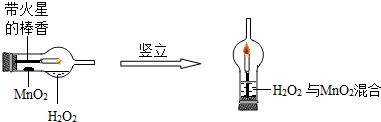
(5分)实验创新是中学生最为重要的科学素养.下图是某学校师生对“MnO2催化H2O2分解实验装置的创新设计”,实验过程如下:
①将一支球形干燥管水平放置,用滴管吸取3ml(密度为lg/ml)质量分数为5%的H2O2加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥的进气管的管壁上。
②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察现象。
请分析回答:
(1)可观察带到火星的棒香立即 。
(2)写出上述实验发生的化学反应方程式 。
(3)下列各项是同学们对该创新实验的评价,你认为评价不合理的是 。(填序号)
| A.实验中所用的仪器、材料及药品均易得到 |
| B.实验使用的药品用量太大 |
| C.反应速度太慢,耽误时间 |
| D.实验现象明显,整个装置好似点燃的灯塔,趣味性强 |
某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
【提出问题】①氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计并完成实验】
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氯化铜均匀混合加热
【实验现象分析】
Ⅲ中x的值应为 ,将实验Ⅰ和Ⅲ比较可证明 ,将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后 和 都不变.
【结论】氧化铜还能作氯酸钾分解的催化剂,请写出实验Ⅲ中的化学反应文字表达式
【实验反思】实验Ⅱ和Ⅲ对比是为了证明
【提出问题】②双氧水分解速度还和什么因素有关
【设计并完成实验】
| |
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生产生O2体积 |
| Ⅰ |
50.0g |
1% |
0.1g |
9mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31mL |
本实验中,测量O2体积的装置是 (填编号)
【结论】在相同条件下,双氧水的浓度越大,双氧水分解得越 。
某化学兴趣小组的同学对空气中氧气的含量进行探究。
【提出问题】空气中氧气的含量是多少?
【查阅资料】①红磷和白磷都能在空气中燃烧,都生成五氧化二磷,但红磷的着火点(可燃物燃烧所需的最低温度)为240℃,白磷的着火点为40℃。
②氧化钙能与反应生成氢氧化钙,同时放出大量的热,能煮熟鸡蛋。
③生石灰的主要成分是氧化钙。
【设计方案】兴趣小组的同学将一个具有刻度和可滑动活塞的玻璃管(其中有空气和白磷)放在装有生石灰的烧杯的上方(如图所示),用此装置进行实验,请你一同参与。

【进行实验】①检查图中玻璃管的气密性。其操作步骤、现象和结论是
②按图示装好药品后的操作是 该操作的作用是
【记录现象】实验过程中观察到的现象是
【实验结论】
【实验反思】本实验是对教材实验稍作改进而设计的,其主要优点是
【拓展与应用】已知, 据此反应能否用镁代替磷测定空气中氧气的体积含量?

由此你对氮气的化学性质有何新的认识
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据下图回答以下问题:
(1)分液漏斗中应放入的物质是____ ___,锥形瓶中应放入的物质是___
(2)写出用该方法制取氧气的化学反应文字表达式: ; 要收集一瓶纯净的氧气,应选择装置 (填字母);
(3)某同学观察到锥形瓶内有大量气泡时,开始用B装置收集氧气,过一段时间后用带火星的木条伸入瓶口、瓶中和瓶底,都末见木条复燃。其原因可能是_______ ________ __
按图组装仪器,关闭止水夹,通电使红磷燃烧。请回答下列问题:
(1)燃烧的现象是 ;
(2)红磷燃烧一段时间后,自动熄灭了,你认为原因是 ;
(3)冷却后,松开止水夹,你观察到的现象为: 。
用下图所示装置测定空气中氧气含量。 
(1)若检查装置的气密性良好后,在集气瓶内加入少量水,并 将水面上方空间分为5等份,在点燃燃烧匙内的足量红磷前还应做的准备工作是__________________________________;
(2)点燃红磷并伸入到空气瓶中,可观察到___________________________________________反应的文字表达式为__________________________ 。
(3)待_______________时,打开弹簧夹,此时观察到的实验现象是__________________________
出现该现象的原因是_____________________________________________________________;
(4)该实验中,集气瓶内压强的变化过程是___________________________________。
空气中氧气含量测定的再认识。
【实验回顾】实验室用红磷燃烧来测定空气中氧气含量。
(1)写出红磷燃烧的化学方程式 (33) 。
(2)实验原理:红磷燃烧消耗氧气,使瓶内 (34) 减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。

【问题提出】有资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
【实验改进】
Ⅰ. 根据铁在空气中生锈的原理设计右图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
Ⅱ.测得实验数据如下表
| 测量项目 |
实验前 |
实验后 |
|
| 烧杯中 水的体积 |
烧杯中 剩余水的体积 |
集气瓶(扣除内容物) 和导管的容积 |
|
| 体积/mL |
80.0 |
54.5 |
126.0 |
【交流表达】
(1)铁生锈过程首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式 。
(2)根据表中数据,改进实验后与铁反应的氧气为 mL,空气中氧气的体积分数是 (计算结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因可能是: 。
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,设计出了如图所示的实验装置。实验步骤如下:(每小格1分,共4分)
①如图所示,连接仪器,发现装置的气密性良好。
②在集气瓶里装a 体积的水,燃烧匙里放一块白磷并在酒精灯上把玻璃棒下端加热,把长导管的另一端放入盛有足量水的烧杯中。
③用力把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即着火燃烧,产生大量白烟,同时放出大量的热。
⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c。
⑥根据a.b.c三个数据,计算出空气中氧气的体积分数。回答下列问题。
(1)在白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化情况是 。
(2)若实验非常成功,请写出a.b.c三个数据应满足的一个等式关系式: 。
(3)组内成员小张对“实验前集气瓶里要装进适量a 体积的水”非常不理解。咨询了组长小明之后,他终于明白“a 体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二则主要是 。
(4)在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值大于理论值的是
| A.装置气密性不好 |
| B.实验前集气瓶里没有装a体积的水 |
| C.集气瓶没有冷却到室温 |
| D.用红磷代替白磷(红磷的着火点在240℃左右) |
根据下列实验装置图,回答有关问题: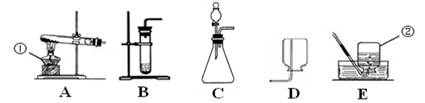
(1)写出图中标号仪器的名称:① ,② 。
(2)实验室用高锰酸钾制取氧气的化学方程式是 ,选用的收集装置是 (选填字母)。
(3)实验室可用氧化钙固体与浓氨水在常温下混合制取少量氨气,为了得到平稳的氨气流,选用的发生装置是 (选填字母)。
(4)用右图甲所示装置做硫在氧气中燃烧的实验,燃烧结束后取出燃烧匙,立即用玻璃片盖住瓶口并振荡,若将集气瓶倒转,发现玻璃片被“吸住”而不掉下来,其原因是
。为完成上述实验,用10mL量筒量取6.0mL氢氧化钠溶液,读数时量筒内的液体凹液面最低处应与右图乙中 处刻度线保持水平(选填“a”或“b”)。
某学习小组对粗盐中杂质(难溶性和可溶性)的去除展开相关探究.
(1)粗盐中难溶性杂质去除的实验步骤为①溶解,②过滤,③ (写操作名称),④计算产率.
(2)步骤②中需要用到的玻璃仪器有:玻璃棒、烧杯、 (写仪器名称),其中玻璃棒的作用是 .
(3)【提出猜想】
甲同学:该粗盐中含有难溶性杂质外,是否还含有可溶性杂质?
(4)【查阅资料】]
①粗盐中可能含有镁盐(Mg 2+)和硫酸盐(SO 4 2 ﹣)等可溶性杂质.
②一些物质的溶解性表
| 阳离子 阴离子 |
OH ﹣ |
CL ﹣ |
SO |
CO |
| Na + |
溶 |
溶 |
溶 |
溶 |
| Ba 2+ |
溶 |
溶 |
不 |
不 |
| Mg 2+ |
不 |
溶 |
溶 |
不 |
说明:"溶"表示该物质可溶于水,"不"表示该物质不溶于水.
③Mg(OH) 2为白色物质,不溶于氢氧化钠溶液;BaSO 4为白色物质,不溶于盐酸;
MgCO 3,BaCO 3为白色物质都能溶于盐酸.
(5)【实验设计】
①取少量除去难溶性杂质后的盐,溶于水配成溶液.
②取少量所配溶液于试管中,滴加氢氧化钠溶液,产生白色沉淀,继续滴加氢氧化钠溶液,沉淀不溶,说明该盐含有可溶性的 盐.
③另取少量所配溶液于试管中,滴加氯化钡溶液,产生白色沉淀,再加稀盐酸,沉淀不溶,说明该盐含有可溶性的 盐.
(6)【实验结论】该盐含有可溶性杂质 .
(7)【实验拓展】以下为乙同学设计的去除食盐中可溶性杂质的试验流程:

①该实验过程中,除杂试剂都要过量,原因是 .
②过量Na 2CO 3溶液用来除 离子(填离子序号).
学习化学知识和技能,可以帮助我们鉴别和检验物质。
(1)在实验室鉴别白酒与白醋,可采用的方法是 。
(2)现有两瓶失去标签的无色溶液,其中一瓶是氢氧化钙溶液,一瓶是稀盐酸。为了鉴别它们,同学们设计了如下实验方案:先给两瓶溶液贴上标签A、B,然后分别取样进行实验。请将横线部分填写完整:
| |
加入的试剂 |
现象 |
结论 |
| 方案1 |
二氧化碳 |
A中出现白色浑浊,B中无明显现象。 |
A是 溶液, B是另一种溶液。 |
| 方案2 |
碳酸钠溶液 |
。 |
|
| 方案3 |
试剂X |
…… |
写出方案1中发生反应的化学方程式 。
【方法感悟】在鉴别物质时,要先分析物质的性质,然后选择恰当的试剂,必须产生不同现象才能达到鉴别物质的目的。
【拓展应用】完成方案3,请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X: 。(填序号)
①酚酞溶液 ②pH试纸 ③镁 ④氧化铜
⑤稀硝酸 ⑥氢氧化铜 ⑦氯化镁溶液 ⑧硝酸钡溶液
(3)小华同学对方案2进一步探究,设计了如下实验方案:
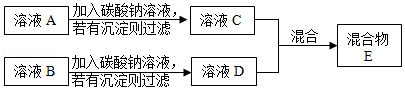
溶液C和溶液D混合,可能会出现以下三种情况:
①有沉淀产生时,写出其中发生反应的化学方程式 。
②有气泡冒出时,可通过现象反推出溶液C中的溶质是 。
③无明显现象时,混合物E中一定含有的溶质是 ;混合物E中所含溶质种类最多时,写出所有溶质的化学式 。
试题篮
()