为确定某一因素对物质溶解性的影响,A、B、C、D四个实验中能与实验I作为一组达到实验目的的是
| 实验编号 |
温度 |
溶剂种类 |
溶剂体积 |
加入固体质量 |
溶解情况 |
| 实验I |
20℃ |
水 |
10 mL |
5 g硝酸钾 |
部分溶解 |
| A |
20℃ |
酒精 |
10 mL |
50 g硝酸钾 |
几乎不溶解 |
| B |
20℃ |
水 |
10 mL |
5 g食盐 |
部分溶解 |
| C |
80℃ |
水 |
20 mL |
5 g硝酸钾 |
全部溶解 |
| D |
80℃ |
水 |
10 mL |
10 g硝酸钾 |
全部溶解 |
下列四个图象分别对应四种操作过程,其中不正确的是:
A B C D
| A.向饱和KNO3溶液中加入KNO3 |
| B.向CaCl2溶液中通入CO2 |
| C.向CuCl2和HCl的混合溶液中加入过量NaOH溶液 |
| D.向两份同体积和同质量分数的HCl溶液中分别加入足量的铁粉和镁粉 |
下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题。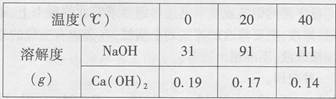
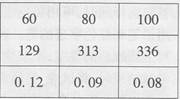
(1)从表中数据可以获得的信息是___________(写一条)。
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是_______;现有20℃是Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙______甲(填>、<、=)。
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答: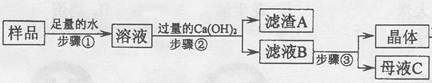
(Ⅰ)步骤①反应的化学方程式为________;加入过量Ca(OH)2的目的是______________。
(Ⅱ)滤液B中的溶质是__________、_________(写化学式);步骤③所包含的具体操作是加热浓缩、_______、过滤。
在下列溶液中分别放入锌片,一段时间后把锌片取出,溶液质量减小的是( )
| A.氯化钠 | B.硫酸亚铁溶液 | C.盐酸 | D.硝酸银溶液 |
根据事物的某些相似性类推其他的相似性,并预测类似的可能性,是我们经常使用的一种思维方法。以下类推结果与实际相符的是
①氧化物中都含有氧元素 含有氧元素的化合物都是氧化物
②饱和溶液不能继续溶解某种溶质 饱和溶液也不能继续溶解其他溶质
③氢氧化钠溶液中有OH一,能与酸反应 氢氧化钾溶液中也有OH一,也能与酸反应
④盐中含有金属离子和酸根离子 NH4NO3中没有金属离子,不属于盐类
| A.①②④ | B.②③④ | C.只有③ | D.①②③④ |
下列四个图像分别表示对应的四种操作过程,其中表示正确的图像是 
| A.向pH=1的酸溶液中不断加水 |
| B.在稀硫酸中加入氢氧化钡溶液,溶液的导电性变化的情况 |
| C.某温度下,向一定量的水中持续加入食盐并不断搅拌 (m:加入食盐的质量,A%:溶质质量分数) |
| D.足量的的锌、铁与等质量、等质量分数稀硫酸反应,产生氢气的质量M与反应时间t的关系图 |
实验小组帮助老师配置25℃(KNO3的溶解度为40g)时KNO3的饱和溶液,以备全班实验使用。老师提供的药品是含有少量NaCl的KNO3固体。(6分)
(1)查阅了两种物质的溶解度曲线,如图所示。40℃时溶解度大的是 ,将此温度下两物质的饱和溶液降温到10℃,此时溶质质量分数大的是 。KNO3中混有少量NaCl的提纯方法是 ,用此法获得了足量的KNO3固体。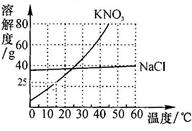
(2)配置100gKNO3饱和溶液的过程如下
①.计算。
②.称量:准确称量KNO3固体 g(保留至0.1g);称取过程中,发现指针已偏向右侧,接下来的操作是 。
③.量取:用量筒量取蒸馏水。
④.溶解:将KNO3固体和水分别加入大烧杯中,搅拌使固体完全溶解。
(3)若小组同学最后配得的KNO3溶液溶质的质量分数偏小,可能的原因是( )
①.用量筒量取水时俯视读数 ②.配制溶液时烧杯用少量蒸馏水润洗 ③.在托盘天平的左盘放砝码,右盘放KNO3称量 ④.天平称量时,指针偏向左盘药品 ⑤.将固体倒入烧杯时有部分洒出
| A.①④ | B.②④⑤ | C.②③⑤ | D.②⑤ |
水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)"生命吸管"(如右图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等。其中活性炭起到和过滤的作用。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为。
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为g。
(4)根据下表回答问题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 /g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
| NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
77.3 |
①60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是溶液。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是(填字母序号)。
A.溶质的质量不变
B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变
D.可升高温度或增加溶剂
下列图像能正确反映其对应操作中各量变化关系的是
| A.图①是给氯酸钾和二氧化锰的混合物加热 |
| B.图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 |
| C.图③是向pH=1的酸溶液中不断加水 |
| D.图④是向一定质量的稀硫酸中加入锌粒 |
下列图象与对应实验完全吻合的是( )
| A.①往一定量的盐酸中滴加NaOH溶液至过量 |
| B.②将一定量的不饱和KNO3溶液恒温蒸发水 |
| C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液 |
| D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2) |
某兴趣小组做了如下实验.
【实验一】提纯NaCl
请根据实验回答下列问题:
(1)操作①、②、③依次为下图中的(填序号) .
(2)若得到NaCl的产率比实际值偏低,则可能的原因是(填序号) .
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.把晶体从蒸发皿转移到天平上称量时,有少量粘在了蒸发皿上
D.溶解11g含有泥沙的NaCl时,加入的水量不足
(3)用上述实验所得的氯化钠配制溶质质量分数为5%的氯化钠溶液50g,不需要的仪器为(填序号) .
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒精灯
【实验二】溶解和结晶KNO3
请根据实验和KNO3溶解度曲线回答下列问题(水的密度以1g/mL计):
| 实验操作 |
实验结果 |
| 取100mL水,加入25gKNO3,搅拌,20℃ |
全部溶解,得溶液① |
| 再加Xg KNO3,搅拌,20℃ |
恰好饱和,得溶液② |
| 再加25g KNO3,搅拌,20℃ |
得溶液③ |
| 加热 |
全部溶解,得溶液④ |
| 冷却至20℃ |
晶体析出,得溶液⑤ |
(4)溶液③的质量为 ;一定属于不饱和溶液的是(填数字序号) ;溶质的质量分数一定相等的是(填序号) .
(5)析出晶体的质量为(填序号) .
A.25g B.X+25g C.X+100g.
试题篮
()