解决淡水资源危机对社会发展有重要意义。小柯设计如图装置模拟海水淡化,请回答:
(1)实验过程中发生的物态变化是 。
(2)实验结束后,向乙装置的试管内滴加硝酸银溶液和稀硝酸,目的是 。
(3)为使冷凝效果更好,可以对乙装置进行的操作是 (写出一点即可)

碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl 2、MgO、HCl气体、H 2O、Cl 2。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有 气体,无其他气体。
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有 。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO 3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有 。
【结论】Mg(OH)Cl受热分解的化学反应方程式为 。

利用饱和碳酸钠溶液与酸反应,小科同学只做了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有( )

A.盐酸B.碳酸钠C.硫酸钠D.氯化钠
下列实验操作中(括号内为杂质)不能达到实验目的是( )
| 选项 |
物质 |
目的 |
主要实验操作 |
| A |
蔗糖、蛋白质溶液 |
鉴别 |
加入饱 溶液,观察现象 |
| B |
固体 |
除杂 |
加入适量稀盐酸,蒸发 |
| C |
和NaCl的混合物 | 分离 |
溶解、过滤、洗涤、烘干、蒸发 |
| D |
空气中NaOH变质程度 |
检验 |
加入足量 溶液,过滤,加酚酞,观察现象 |
A.AB.BC.CD.D
实验室用如图方法制取氢氧化铜固体.
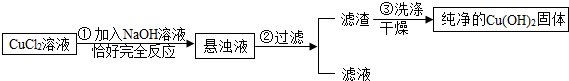
(1)步骤①需配制200克溶质质量分数为4%的NaOH溶液,需NaOH固体 克.
(2)请从图中选取步骤②过滤时需要用到的器材 (可多选).
(3)步骤③中需多次用蒸馏水清洗过滤装置中的滤渣,目的是去除残留在氢氧化铜表面的氯化钠溶液,实验中需要检验清洗后收集到的液体中是否含有氯化钠,写出检验的方法: .
小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的( )

A.硫酸钠B.碳酸钠C.盐酸D.氯化钠
下列说法正确的是( )
| A. |
酸碱中和反应生成盐和水,生成盐和水的反应一定是中和反应 |
| B. |
向固体中滴加稀盐酸,有气泡产生,该固体不一定是碳酸盐 |
| C. |
CO 2能灭火,将燃着的镁条伸入充满CO 2的瓶中,镁条立即熄灭 |
| D. |
农作物生长需要N、P、K等元素,为增加肥效,可把NH 4H 2PO 4与草木灰混合施用 |
实验室有一包白色固体由 K2CO3、K2SO4、KCl和CuSO4中的一种或几种组成,实验记录如下:
①取该样品溶于水,得到无色溶液;
②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;
③向步骤②所得沉淀中加入过量的稀HNO3,沉淀全部消失并产生气泡。
下列分析中正确的是( )
A.原固体中一定含有K2CO3,可能含有CuSO4和KCl
B.原固体中一定不含K2SO4和CuSO4、可能含有KCl
C.原固体中一定含有K2CO3和K2SO4,一定不含CuSO4
D.若在步骤②所得滤液中滴入AgNO3溶液,出现白色沉淀,则原固体中一定含有KCl
下列实验不能得出对应结论的是 ( )
选项 |
操作 |
现象 |
结论 |
A |
向50mL集满CO2的软塑料瓶中加入50mL水,迅速拧紧瓶盖,振荡 |
塑料瓶变瘪 |
CO2能溶于水 |
B |
将铁钉放入CuSO4溶液中 |
铁钉表面析出红色物质 |
铁比铜活泼 |
C |
苹果片上滴加碘水 |
苹果片表面变蓝 |
苹果含淀粉 |
D |
向某无色溶液滴加石蕊 |
溶液变红 |
无色溶液是盐酸 |
A.AB.BC.CD.D
粗盐提纯是初中化学的基础实验之一。
(1)粗盐提纯的实验基本操作步骤为 。
(2)下列仪器中,①仪器G的名称是 ;②粗盐提纯实验中不会用到的仪器(填字母)是 。

(3)经上述操作得到的产品中仍可能含有可溶性的硫酸盐,要检验硫酸盐的存在,其操作为:取少量产品溶于水,并加入过量稀盐酸,再滴加试剂(填化学式) 溶液,观察是否有沉淀产生。
在氯化钡溶液中滴入某种液体,生成白色沉淀.有关说法错误的是( )
A.滴入的可能是硝酸银溶液
B.反应后溶液可能呈酸性
C.白色沉淀可能溶于盐酸
D.该反应可能是中和反应
物质的鉴别、分离和提纯是重要的基本实验操作.
(1)鉴别氢氧化钠和碳酸钠两种溶液,不可选择 (填字母)
A.氯化钡溶液 B.硝酸钠溶液 C.稀硫酸
(2)除去硝酸钾溶液中混有的少量硫酸钾,可加入适量的硝酸钡溶液,充分反应过滤即可.写出反应的化学方程式 .
学习化学知识和技能,可以帮助我们鉴别和检验物质。
(1)在实验室鉴别白酒与白醋,可采用的方法是 。
(2)现有两瓶失去标签的无色溶液,其中一瓶是氢氧化钙溶液,一瓶是稀盐酸。为了鉴别它们,同学们设计了如下实验方案:先给两瓶溶液贴上标签A、B,然后分别取样进行实验。请将横线部分填写完整:
| |
加入的试剂 |
现象 |
结论 |
| 方案1 |
二氧化碳 |
A中出现白色浑浊,B中无明显现象。 |
A是 溶液, B是另一种溶液。 |
| 方案2 |
碳酸钠溶液 |
。 |
|
| 方案3 |
试剂X |
…… |
写出方案1中发生反应的化学方程式 。
【方法感悟】在鉴别物质时,要先分析物质的性质,然后选择恰当的试剂,必须产生不同现象才能达到鉴别物质的目的。
【拓展应用】完成方案3,请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X: 。(填序号)
①酚酞溶液 ②pH试纸 ③镁 ④氧化铜
⑤稀硝酸 ⑥氢氧化铜 ⑦氯化镁溶液 ⑧硝酸钡溶液
(3)小华同学对方案2进一步探究,设计了如下实验方案:
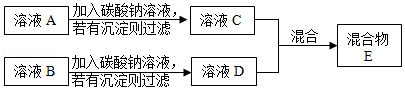
溶液C和溶液D混合,可能会出现以下三种情况:
①有沉淀产生时,写出其中发生反应的化学方程式 。
②有气泡冒出时,可通过现象反推出溶液C中的溶质是 。
③无明显现象时,混合物E中一定含有的溶质是 ;混合物E中所含溶质种类最多时,写出所有溶质的化学式 。
氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为 。
A、B两支试管中共同的实验现象是 。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是 (填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
【提出猜想】猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 |
实验现象 |
实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 |
|
猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 |
产生白色沉淀, 酚酞溶液变红 |
猜想2成立 |
【反思与评价】I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是 。
若要验证猜想2成立,需将Ca(OH)2溶液换成 溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是 (用文字叙述)
试题篮
()