真空热还原法生产钙的主要转化过程如图:

(1)石灰石的主要成分是 。
(2)Ⅱ中反应有两种产物,固体X一定含有氧元素和铝元素,从元素守恒角度说明理由 。
(3)装置Ⅲ中发生的是 (填“物理”或“化学”)变化。
钛和钛合金被认为是21世纪的重要金属材料,广泛应用于航天、医疗等领域。工业上以金红石(主要成分为TiO 2)为原料生产钛金属,流程如图1:

根据流程图信息,回答下列问题:
(1)钛在元素周期表中的信息如图2,钛原子的质子数是 。
(2)反应①的化学方程式为 。
(3)反应②的基本反应类型是 。
(4)反应②是在氩气环境下进行的,氩气的作用是 。
(5)航天飞机常用到钛合金,是因为钛合金具备很多优良性能,如 。(请你写出一点)。
海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
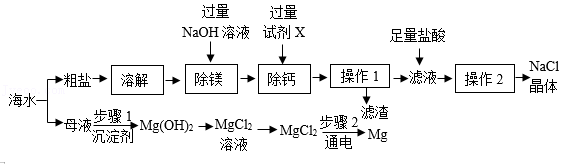
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO 2、Fe 2O 3、MgSO 4等杂质)为原料,生产无水氯化钙的流程如图:
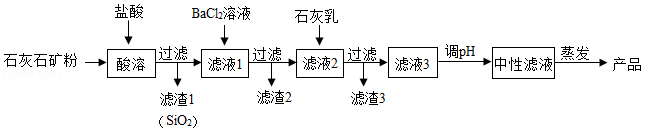
回答下列问题:
(1)从流程图中推知:SiO 2具有的化学性质是 。
(2)氧化铁与盐酸反应的化学方程式为 。
(3)滤渣3中除有Ca(OH) 2外,还有 (填化学式,下同)。
(4)产品中的杂质除极少量H 2O外,最有可能含的是 。
国产航母"山东舰"威武入列,标志我国金属材料制造技术取得重大突破。
(1)"山东舰"是由多块巨大的特种钢板焊接而成。工业上用CO和赤铁矿(主要成分是Fe 2O 3)反应得到铁,反应的化学方程式是 。工人师傅常用氧炔焰焊接钢板,乙炔(C 2H 2)在氧气中完全燃烧的化学方程式是 。
(2)钛合金可用于制作舰载机的起落架,主要是利用了钛合金物理性质中的 。如图是以钛酸亚铁(FeTiO 3)为原料制取钛(Ti)的部分流程示意图:
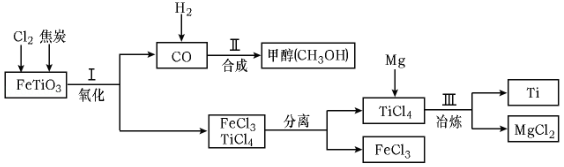
①FeTiO 3中钛元素的化合价为 价。
②过程Ⅱ合成甲醇(CH 3OH)时,按照绿色化学的原则,应调节原料中CO和H 2的分子个数比是 。过程Ⅲ中,在800℃的条件下冶炼钛的化学方程式是 。
(3)金属防锈常用电镀的方法,电镀防锈的原理是 。某电镀厂的废液中含有硝酸银和硝酸铜,兴趣小组的同学在实验室探究回收该废液中的金属。将一定量铁粉加入到盛有一定量废液样品的烧杯中,充分反应后过滤,得到滤渣A。向滤渣A中加入少量稀盐酸,有气泡产生,该反应的化学方程式是 。据此分析,滤渣A的成分是 (写化学式)。
蔗糖是储藏在某些植物中的糖,日常生活中食用的白糖、冰糖的主要成分就是蔗糖,它是食品中常用的甜味剂。工业制备蔗糖的流程如图所示。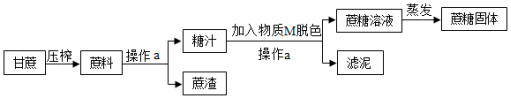
(1)操作a的名称是 。
(2)上述流程中物质M可能是 。
(3)在实验室进行蒸发操作时,要用到玻璃棒,其作用是 。
(4)蔗糖(C12H22O11)属于 (填“有机化合物”或“无机化合物”)。
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示:
请回答下列问题:
(1)工厂废液中加入过量A反应的化学方程式为 。
(2)用化学式表示固体甲的成分 。
(3)溶液甲中的金属离子是 (用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2 ═4Fe(OH)3。
如图是实验室模拟工业上用大理石(含少量Fe 2O 3和SiO 2)为原料提纯碳酸钙的实验流程,请回答下列问题:
已知:①SiO 2不溶于水也不溶于酸
②氨水呈碱性,与盐酸反应的化学方程式为:NH 3•H 2O+HCl=NH 4Cl+H 2O
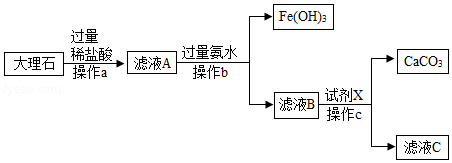
(1)稀盐酸不能用稀硫酸代替,原因是 。
(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)写出滤液A中加氨水生成Fe(OH) 3的化学方程式 。
(4)滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为 。
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.
(1)为了除去粗盐溶液中的Ca 2+、Mg 2+、SO 4 2﹣,可按照下列实验步骤进行:①加过量BaCl 2溶液②加过量NaOH溶液③加过量Na 2CO 3溶液④过滤⑤加入适量盐酸.其中步骤③加过量Na 2CO 3溶液的目的是 .
(2)利用苦卤制取镁,主要流程如图:

步骤Ⅱ中的试剂a是 .步骤Ⅰ中反应的化学方程式是 .
(3)采用氨碱法生产纯碱,主要流程如图:

①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是 .
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是 .
空气是宝贵的自然资源,如图是以空气等为原料合成尿素[CO(NH 2) 2]的流程。请按要求回答相关问题:

(1)空气属于 (填"纯净物"或"混合物"),X是空气中含量最多的气体,其分子式为 。
(2)图中分离空气的过程属于 变化(填"物理"或"化学")。
(3)空气中含有的少量稀有气体的化学性质 (填"活泼"或"稳定")。
(4)实验室用大理石和稀盐酸制取二氧化碳的化学反应方程式为 ;二氧化碳的密度比空气 (填"大"或"小")。
(5)①天然气的主要成分是CH 4,天然气属于 再生资源(填"可"或"不可")。
②点燃CH 4之前应 。 8g CH 4完全燃烧消耗32gO 2,生成agCO 2和18gH 2O,则a= 。
③由CH 4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有 变化(填"能量"或"原子个数")。
(6)尿素属于 (填"氮肥"、"磷肥"或"钾肥");写出NH 3合成尿素的化学反应方程式 。
电子工业上制造铜电路板,常用30%的FeCl3溶液腐蚀镀铜电路板上的铜箔(Cu),如图是某兴趣小组设计的处理该生产过程中产生废液的流程图,据如图回答下列问题:
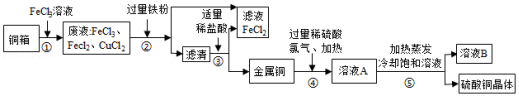
查阅资料:2Cu+2H2SO4+O2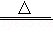 2CuSO4+2H2O;2FeCl3+Fe═3FeCl2
2CuSO4+2H2O;2FeCl3+Fe═3FeCl2
(1)步骤①所得的废液中只含有FeCl3、CuCl2、FeCl2三种溶质,据此可判断步骤①中铜与FeCl3反应生成的两种产物是 (写化学式)。
(2)步骤②中加入的铁粉与氯化铜发生反应的化学方程式是 ,步骤②还需要进行的实验操作是 。
(3)步骤③加入适量稀盐酸充分反应。当观察到 现象时,说明滤液中只剩下铜。
(4)步骤②③所得FeCl2可与一种气体单质发生化合反应生成FeCl3,实现循环使用,根据质量守恒定律可推测该单质是 。
(5)溶液B中含有的溶质是 。
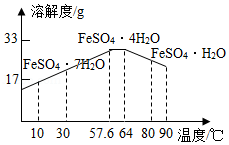
某工厂以含有FeSO4和少量H2SO4的废水为原料制备FeSO4•7H2O的步骤如下:
①调节废水pH;②过滤;③蒸发浓缩;④结晶池中结晶;⑤收集晶体,洗涤、干燥。
(1)调节废水pH时,适宜加入 。(填序号)
a.Fe b.Cu c.Ca(OH)2
(2)实验室中,完成过滤操作需要的玻璃仪器有玻璃棒、 和 ,过滤和蒸发操作中玻璃棒的作用分别是 、 。
(3)结晶池底部有一定坡度的主要目的是 。
(4)用冰水洗涤FeSO4•7H2O晶体的目的是 。低温干燥的目的是 。
(5)结合如图,补充完整由硫酸亚铁溶液中结晶出FeSO4•4H2O的实验方案:蒸发浓缩, ,过滤、洗涤、干燥。
有限的元素可以组成种类繁多的物质,依据表中的元素回答下列问题。
| 元素名称 |
铜 |
钠 |
钙 |
氧 |
碳 |
氢 |
| 元素符号 |
Cu |
Na |
Ca |
O |
C |
H |
(1)常用作冶炼金属的还原剂是 (任写一种物质的化学式)。
(2)能使紫色石蕊溶液变红的有机物是 (写化学式)。
(3)战国《周礼》中记载"煤饼烧蛎房(即牡蛎壳)成灰",蔡伦将此"灰"溶于水即得碱。请写出蛎房烧成灰的化学方程式 。
(4)甲、乙、丙都是由以上元素组成的初中化学常见物质,其中甲为氧化物,它们之间有如图所示转化关系(部分反应物、生成物及反应条件已略去,"→"表示某一种物质经一步反应可转化为另一种物质)。
①若丙为黑色固体,则乙→丙发生反应的化学方程式为 。
②下列推断正确的是 (填序号)。
| A. |
a.甲只能为H 2O或CO 2 |
| B. |
b.乙可以为氧化物或碱、盐 |
| C. |
c.乙和丙不可能为同种类别的物质 |
| D. |
d.丙→甲发生的反应可能是化合反应或分解反应、置换反应、复分解反应 |

通过晾晒海水或者煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐.粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).工业上以粗盐为原料制取精盐,其生产流程如图所示:
请回答下列问题:

(1)已知操作a、b、c中均含同一种操作,其名称是 .
(2)将足量稀盐酸加入溶液C中,反应的化学方程式为(任写一个) .
(3)在蒸发操作中,用玻璃棒搅拌的作用是 .
(4)如果称量Ⅰ中称得粗盐的质量为5g,称量Ⅱ中称得精盐的质量为5.1g,则下列分析正确的是 .
| A. |
精盐的产率一定为98.04% |
| B. |
精盐的产率一定为102% |
| C. |
蒸发操作中可能有水分没有蒸干 |
| D. |
溶解操作中可能有粗盐没有溶解 |
| E. |
除杂过程中有NaCl生成. |
试题篮
()