碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ.以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为 。
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O,温度升高,说明该反应 热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率= ×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。
×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。

(3)分离:得到产品。
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数。
已知:a.MnO2与稀盐酸不反应 b.MgO2+2HCl=MgCl2+H2O2
c.2MgO2 2MgO+O2↑ d.MgO+C
2MgO+O2↑ d.MgO+C Mg+CO↑
Mg+CO↑
①仪器M的名称是 ,MnO2的作用是 。
②相同条件下, 能使测定结果更准确。(填图2中“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g•mL-1的浓盐酸配制10%的稀盐酸110g,需要水 mL.(水的密度是1g•mL﹣1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是 。(填序号)
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
Ⅱ.MgCl2是制备Mg2(OH)2CO3的原料,现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:MgCO3+Cl2+CO MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
某工厂以含有FeSO4和少量H2SO4的废水为原料制备FeSO4•7H2O的步骤如下:
①调节废水pH;②过滤;③蒸发浓缩;④结晶池中结晶;⑤收集晶体,洗涤、干燥。
(1)调节废水pH时,适宜加入 。(填序号)
a.Fe b.Cu c.Ca(OH)2
(2)实验室中,完成过滤操作需要的玻璃仪器有玻璃棒、 和 ,过滤和蒸发操作中玻璃棒的作用分别是 、 。
(3)结晶池底部有一定坡度的主要目的是 。
(4)用冰水洗涤FeSO4•7H2O晶体的目的是 。低温干燥的目的是 。
(5)结合如图,补充完整由硫酸亚铁溶液中结晶出FeSO4•4H2O的实验方案:蒸发浓缩, ,过滤、洗涤、干燥。
分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )
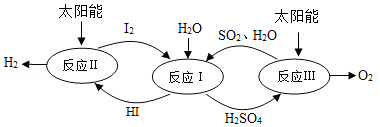
A.反应过程中化合价改变的元素有H、O、S、I
B.涉及的反应类型有分解反应和化合反应
C.理论上,每生成16gO2,就能得到2gH2
D.理论上,每分解18gH2O,就需向体系内再补充32gSO2
二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:(1)3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O
(2)K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为 。其反应类型是 。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,用稀硫酸而不用水浸取的原因是 。
Ⅱ.用硫酸锰制备:电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为 ,一段时间后溶液的pH将 (填“变大”、“变小”或“不变”)
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O═2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:

请回答下列问题:
(1)“滤液”中溶质的主要成分是 (填化学式)。
(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和 。
(3)MnO2与碳粉经下列三步反应制得纳米MnO2:
①2MnO2+C  2MnO+CO2↑
2MnO+CO2↑
②MnO+H2SO4═MnSO4+H2O
③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有 (填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:

(1)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式 。
(2)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示。图中B点对应固体成分的化学式为 (请写出计算过程)
硅酸钠(Na2SiO3)是我国优先发展的精细化学品,用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)制备硅酸钠(Na2SiO3)的流程如下:

资料:SiO2既不溶于水,也不与盐酸反应。
请回答下列问题:
(1)“研磨”的目的是 。
(2)检验“洗涤a”已洗净的方法是 。
(3)“酸浸”的化学方程式为 。
(4)“碱浸”的化学方程式为 。
(5)“操作a”包含蒸发浓缩、 、过滤、洗涤、干燥等一系列操作。
某工厂产生的烧渣(主要含FeO、Fe 2O 3,还有一定量的SiO 2)可用于制备七水合硫酸亚铁晶体(FeSO 4•7H 2O),其工艺流程如下:

查阅资料:SiO 2不溶于水,也不与稀硫酸反应。
(1)"浸取"步骤中,FeO、Fe 2O 3和稀硫酸发生反应的化学方程式分别为
FeO+H 2SO 4=FeSO 4+H 2O、 。
(2)为提高"浸取"步骤的反应速率,可采取的具体措施有 (写2条,不考虑"搅拌"和"使用催化剂")。
(3)"还原"步骤的目的是将Fe 3+转化为Fe 2+,试剂X可用SO 2或Fe。
①若试剂X是SO 2,转化原理为SO 2+Fe 2(SO 4) 3+2Y═2FeSO 4+2H 2SO 4,则Y的化学式是 。
②若试剂X是Fe,转化原理为Fe+Fe 2(SO 4) 3=3FeSO 4.测得"还原"后溶液的pH明显增大,其原因是 。
实验室以MnO 2为原料制备少量高纯MnCO 3的流程如下:
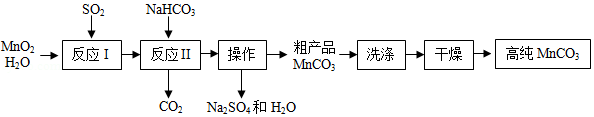
已知:①反应Ⅰ的化学方程式:MnO 2+SO 2═MnSO 4;
②MnCO 3、Mn(OH) 2均难溶于水,MnCO 3在100℃时开始分解。
(1)反应Ⅰ属于基本反应类型中的 反应。
(2)流程中"操作"的名称为 ,所需要的主要玻璃仪器有 。
(3)反应Ⅱ的化学方程式为 。反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO 3粗产品中将混有 (填化学式)。
(4)验证MnCO 3粗产品表面附着有Na 2SO 4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的 (填化学式)溶液,有白色沉淀产生。
(5)为获得高纯MnCO 3,需选择"低温"干燥的原因是 。
海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是:溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻的斜靠在 一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是 。
②下列操作可能导致精盐产率偏高的是 (填字母)
a.食盐没有完全溶解即过滤 b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。如图1是从海水中获得氯化镁溶液的流程。
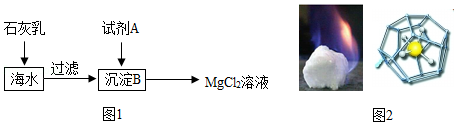
①在海水中加入石灰乳后,发生反应的化学方程式是 。
②上述过程中试剂A与沉淀B发生的是中和反应,则试剂A是(填名称) 。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4•nH 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于 (选填"纯净物"或"混合物")。
②若某种可燃冰中CH 4与H 2O的质量比是1:9,则该可燃冰中n= 。
③可燃冰中甲烷完全燃烧的化学方程式是 。
氯化镁是一种重要的化工原料,同学们在实验室对其开展了系列研究.
课题1:选择制取氯化镁的原料
【查阅资料】
①全球海水中含有的盐类总质量为5亿吨,其中含有的各种离子占盐类总质量的百分含量如下表所示:
离子 |
Cl﹣ |
Na+ |
Mg2+ |
Ca2+ |
K+ |
其他 |
含量 |
55.06% |
30.61% |
3.69% |
1.15% |
1.10% |
… |
②工业生产中海水或卤水(海水晒盐后的剩余溶液)都可以作为制取氯化镁的原料.
【交流讨论】
同学们经讨论,一致选择卤水用于实验室制取氯化镁.你认为他们的理由是
.
课题2:由卤水制取氯化镁
同学们设计如图所示方案,从卤水中制取氯化镁.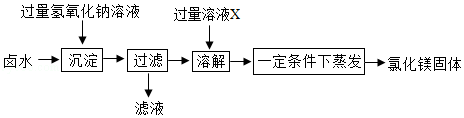
(1)溶液X的名称是 .
(2)部分同学认为上述制取方案不够完善,在“过滤”操作后缺少“洗涤”操作,从而导致制取的氯化镁不纯,可能混有的杂质是 .
课题3:测定氯化镁产品的纯度(氯化镁的质量分数)
同学们设计如下实验方案对制得的氯化镁进行纯度测定.
【实验步骤】
①称取9.5g氯化镁样品,放于烧杯中,加足量的水溶解,形成溶液;
②向上述溶液中加入90g质量分数为10%的氢氧化钠溶液;
③充分反应后,过滤;
④…
⑤向所得溶液中加入几滴无色酚酞试液,溶液变红,再逐滴加入10%稀硫酸(密度为1.07g•mL﹣1),并 ,当观察到溶液恰好褪色且30s内红色不复现,停止加入稀硫酸;
⑥计算氯化镁样品的纯度.
【问题讨论】
(1)为计算出氯化镁样品的纯度,除上述数据外,实验还需测量的数据是 .
(2)若缺少步骤④,则会导致氯化镁纯度测定不准确,步骤④的操作是 .
工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图
(1)“转化”时在溶液中生成了FeCO3沉淀,从四种基本反应类型来看,该反应的类型是 ;“过滤”后得到的滤液中的溶质有 (填化学式)
(2)“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有 (填化学式);FeCO3和FeOOH在空气中焙烧转化为Fe2O3,写出Fe2O3在高温条件下与C反应生成Fe和CO2的化学方程式 。
(3)制得的还原铁粉中含有Fe和少量FexC.为确定FexC的化学式,进行了如下实验:
①取14.06g还原铁粉在氧气流中充分加热,得到0.22g CO2;
②另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48g H2.FexC的化学式是 。
在一定条件下,下列物质间的转化不能一步实现的是( )
A.S→SO3B.CO2→O2
C.Fe3O4→FeD.Ca(OH)2→NaOH
实验室利用反应所得CuSO4稀H2SO4混合液制备CuSO4“5H2O,其主要流程如图:

(1)试剂X应选用 (选填序号).
a.Cu b.CuO c.Fe
(2)操作A中,所用玻璃仪器有 、玻璃棒、烧杯.
(3)操作B为蒸发浓缩、 、过滤.
(4)操作C为洗涤、低温干燥,其中洗涤剂不可选用 (选填序号).
a.热水 b.冰水 c.饱和CuSO4溶液.
硫酸铜在纺织、印刷等行业有广泛用途.
(1)工业上可用铜屑、空气与稀硫酸在80℃条件下制备硫酸铜.
①如图1是实验室模拟工业制备硫酸铜的装置.反应的化学方程式为 ,采用水浴加热的优点是 ,多孔球泡的作用为 .

②工业生产时可用纯氧代替空气.这一措施能加快反应速率外,还具有的优点是 .
③实验室用H 2O 2溶液和MnO 2制备O 2,反应的化学方程式为 ,在图2中,应选用的发生装置为 (填序号,下同),收集装置为 .
(2)以CuSO 4为原料制备碱式碳酸铜[Cu 2(OH) 2CO 3]的过程如图3:

①"沉淀"时的反应为:2CuSO 4+2Na 2CO 3+H 2O=Cu 2(OH) 2CO 3↓+2 +CO 2↑
②检验沉淀是否洗涤干净选用的试剂是 (填化学式),烘干时产品中出现少量黑色物质,可能的原因为 .
③若所得产品的产率(产率=  ×100%)偏高,其可能的原因为 (填序号)
×100%)偏高,其可能的原因为 (填序号)
a.反应物为完全沉淀 b.过滤时滤纸破损
c.Cu 2(OH) 2CO 3未洗涤干净 d.Cu 2(OH) 2CO 3未完全烘干
④"沉淀"时若有少量5Cu(OH) 2•2CuCO 3生成,则产品中铜元素的质量分数 (填"偏大""不变"或"偏小")
(3)T℃时加热32.0g硫酸铜,一段时间后得到15.2gCuO和Cu 2O的混合物,计算该混合物中CuO的质量(写出计算过程)
碳酸钙是一种重要的无机化工产品,工业上有重质碳酸钙、轻质碳酸钙、纳米碳酸钙等不同品种.以下是两种碳酸钙产品的主要生产过程.请回答下列问题:
| 原料 |
主要生产过程 |
产品 |
|
| 石灰石 |
1.高温煅烧,得到固体A与气体B 2.固体A与水反应,净化后得到石灰乳 |
石灰乳与B反应 |
轻质碳酸钙 |
| 石灰乳与适量盐酸反应得溶液C,C中加入氨水同时通入B |
纳米碳酸钙 |
||
(1)A的主要成分俗称 ,A与水的反应过程中 (填"吸收"或"放出")热量.石灰乳的主要成分是 .
(2)石灰乳中加入纯碱溶液,也可得到碳酸钙,请写出该反应的化学方程式 ,该反应属于 (填基本反应类型)反应.
(3)C溶液中的溶质是 ,C与氨水、气体B反应除得到纳米碳酸钙之外,另一种副产品是 .
试题篮
()