为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下

请根据以上流程图中的信息.回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是 ;
(2)步骤④中加过量碳酸钾溶液的目的是 ;
(3)此设计方案是否严谨?并说明理由 .
下列各组物质中,按如图所示的箭头方向转化,都能通过一步反应实现的是( )
选项 |
甲 |
乙 |
丙 |
丁 |
A |
CaO |
Ca(OH)2 |
CaCO3 |
CaCl2 |
B |
NaOH |
Na2SO4 |
NaNO3 |
Na2CO3 |
C |
O2 |
CuO |
CO2 |
H2O |
D |
H2O2 |
H2 |
Fe2O3 |
FeCl3 |
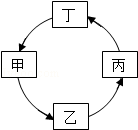
A.AB.BC.CD.D
我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:

【小资料】
I、贝壳的主要成分是CaCO3
Ⅱ、通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳
Ⅲ、饱和食盐水中发生的主要反应为:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(1)合成氨需要的氮气来自空气,空气属于 (填“混合物”或“纯净物”)。空气中氮气的体积分数约为 。
(2)过程②中主要操作的名称是 。
(3)过程①中发生反应的化学方程式为 ,过程③中反应所属基本反应类型为 。
(4)为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入 (填“NH3”或“CO2”),你的理由是: 。
(5)上述流程中可以循环利用的物质是: (填化学式)
海水中含有丰富的镁,目前世界上生成的镁60%来自于海水。分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2.工业上以苦卤水为原料制取金属镁的流程如图:

(1)写出沉淀槽中发生反应的化学方程式 , 。
(2)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的循环利用,则Z的化学式为 ,X溶液的名称是 。
(3)烘干后得到的MgCl2中可能含有的杂质是 。
下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是( )
选项 |
A |
B |
C |
D |
|
转化关系 |
|
|
|
|
|
物质 |
甲 |
H2O2 |
C |
CaCO3 |
FeCl2 |
乙 |
O2 |
CO |
CO2 |
Fe |
|
丙 |
H2O |
CO2 |
Na2CO3 |
Fe2O3 |
|
A.AB.BC.CD.D
实验室有氧化铜和铁的混合粉末,为提炼其中的铜,取等质量样品,分别进行了两个实验。
实验一

①分离得到溶液C的操作名称是 。
②写出步骤II中反应的化学方程式 。
③上述步骤 (选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二

④写出步骤Ⅳ中反应的化学方程式 。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称,判断能否得出D、E溶液中该溶质质量的大小关系并说明理由。
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.
2+2+42﹣22323溶液的目的是 .
(2)利用苦卤制取镁,主要流程如图:

步骤Ⅱ中的试剂a是 .步骤Ⅰ中反应的化学方程式是 .
(3)采用氨碱法生产纯碱,主要流程如图:

①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是 .
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是 .
高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:

(1)完成操作③所需要的玻璃仪器是 (填一种即可);实验中通过操作②所析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而 ;
(2)操作流程中可循环利用的物质是 ;
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为 。
高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:

(1)完成操作③所需要的玻璃仪器是 (填一种即可);实验中通过操作②所析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而 ;
(2)操作流程中可循环利用的物质是 ;
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为 。
氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
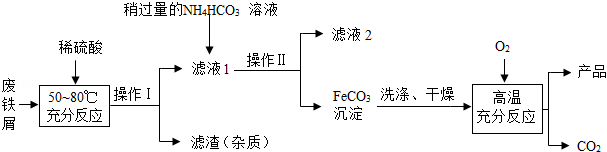
(1)操作Ⅰ、Ⅱ的名称是 ;
(2)向废铁屑中加入的稀硫酸需过量,其目的是 ;
(3)高温条件下,FeCO 3与通入的O 2发生反应的化学方程式是 。
海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如:氯化钠、镁等.如图就是利用海水提取氯化钠的大致过程:

(1)图中①是 (填“蒸发池”或“冷却池”);
(2)析出晶体后的母液是氯化钠的 (填“饱和溶液”或“不饱和溶液”);
(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:
Ⅰ溶解Ⅱ (填操作名称)Ⅲ蒸发
(4)提取粗盐后的母液中含有较多氯化镁,从母液中提取金属镁的过程大致如下:

该过程中反应Ⅰ的基本反应类型是 ;
写出反应Ⅱ的化学方程式为 .
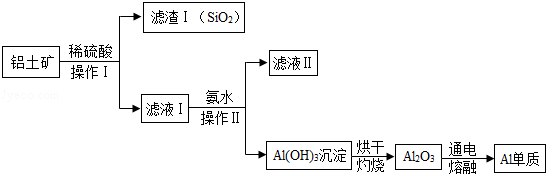
铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al 2O 3和SiO 2,不考虑其它杂质)制取金属铝的基本流程如下:
已知:①SiO 2是一种难溶于水,也不与盐酸、硫酸反应的物质。
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
请回答下列问题:
(1)Al 2O 3与稀硫酸反应的化学方程式为 。
(2)操作Ⅱ的名称是 。
(3)滤液Ⅱ中溶质的用途之一是 。
(4)电解熔融的Al 2O 3,除得到金属铝之外,还可得到的气体产物是 (填化学式)。
工业上电解熔融的Al 2O 3时,还加入了冰晶石(Na 3AlF 6)作熔剂,其作用是降低Al 2O 3的熔点,冰晶石在物质中的分类属于 (填字母)。
A.酸B.碱C.盐D.氧化物
某兴趣小组的同学从实验收集到一桶含有FeSO 4、CuSO 4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:

(1)固体A中含有 和 ,无色气体X为 H 2 (均填化学式).
(2)步骤①中反应的化学方程式为 ,该反应属于四种基本类型中的 反应.
(3)操作a的名称为 ,在该操作中用到了玻璃棒其作用为 .
(4)理论上所得硫酸亚铁晶体的质量 (填">""<"或"=")原废液中硫酸亚铁的质量.
通过晾晒海水或者煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐.粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).工业上以粗盐为原料制取精盐,其生产流程如图所示:
请回答下列问题:

(1)已知操作a、b、c中均含同一种操作,其名称是 .
(2)将足量稀盐酸加入溶液C中,反应的化学方程式为(任写一个) .
(3)在蒸发操作中,用玻璃棒搅拌的作用是 .
(4)如果称量Ⅰ中称得粗盐的质量为5g,称量Ⅱ中称得精盐的质量为5.1g,则下列分析正确的是 .
| A. |
精盐的产率一定为98.04% |
| B. |
精盐的产率一定为102% |
| C. |
蒸发操作中可能有水分没有蒸干 |
| D. |
溶解操作中可能有粗盐没有溶解 |
| E. |
除杂过程中有NaCl生成. |
通过化学变化可以制备物质。
(1)某兴趣小组欲用200g 4%的氢氧化钠溶液吸收二氧化碳制备碳酸钠,反应的化学方程式是 ;若要将提供的氢氧化钠全部转化为碳酸钠,请列出计算需二氧化碳质量(x)的比例式 ;
(2)在实验中,该小组同学发现,要定量控制通入氢氧化钠溶液中二氧化碳气体的质量,难以操作。请分析若通入二氧化碳气体的量不足时会导致产物中混有的杂质是 ;
(3)查阅资料:
Na2CO3+CO2+H2O=2NaHCO3;
NaHCO3+NaOH=Na2CO3+H2O;
该小组同学将制备方案改进如下:
步骤 |
实验操作 |
实验目的 |
一 |
将200g 4%的NaOH溶液分为两等份 |
/ |
二 |
① |
将其中一份溶液中的NaOH全部转化为NaHCO3 |
三 |
将步骤二所得溶液小心煮沸1﹣2分钟 |
② |
四 |
③ |
将NaHCO3全部转化为Na2CO3 |
(4)假设每步转化都完全,该小组同学利用改进后的方案制取的碳酸钠质量m1= g;经老师指导,该小组同学将步骤四反应后的溶液蒸干并充分灼烧得到碳酸钠粉末的质量为m2g,发现m1=m2,由此证明他们的方案改进成功。
试题篮
()