如图所示,某实验小组进行以下实验:
(1)上述实验进行对比的目的是 .
(2)实验后,将A、B两试管中的溶液倒入同一个洁净的烧杯中,溶液无色.再向其中加入一定量的碳酸钠溶液(提示:CaCl2+Na2CO3═CaCO3↓+2NaCl),所得混合物中溶液的溶质成分有四种情况,请补充完整(酚酞省略不写):①NaCl;② ;③ ;④ .若该混合物中溶液无色,选用一种试剂即可确定溶质成分是哪种情况,写出所加试剂,预期现象和结论.
下列实验中可观察到明显现象的是
| A.向盐酸中滴加氢氧化钠溶液 | B.向盐酸中滴加酚酞溶液 |
| C.将铁锈放入到稀硫酸溶液中 | D.向氯化钡溶液中滴加氢氧化钠溶液 |
数字化装备正逐步进入宜昌市的各个校园。在盐酸和氢氧化钠反应的过程中,下图是利用数字化传感器得到的溶液
变化图像。

(1)反应的化学方程式为;
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是
;
(3)图中
点所示溶液中,含有的溶质是。
向装有50 g稀硫酸的小烧杯中,不断慢慢滴加 10% 的Ba(OH)2溶液至过量。加入Ba(OH)2溶液的质量与小烧杯中有关量(纵坐标)的变化关系如下图。其中肯定不正确的是
小明学习了酸碱指示剂后,根据探究活动的提示,在家中自制紫甘蓝汁酸碱指示剂.小明在家中找到了如下用品:废塑料盒、捣蒜用的杵、筷子、纱布、白酒、紫甘蓝,并用这些用品完成了实验.
第一步:制紫甘蓝汁.
①将紫甘蓝在废塑料盒中捣烂,加入浸泡一段时间;
②将①中得到的不溶物与液体分离,(写具体做法),得到了自制的紫甘蓝汁.
第二步:小明欲用制得的紫甘蓝汁测出家中炉具清洁剂和厕所清洁剂的酸碱性,先上网查得下列资料,如表所示:
| 在不同溶液中的颜色变化 |
||
| 盐酸 |
氢氧化钠溶液 |
|
| 紫甘蓝汁 |
红色 |
黄色 |
第三步:小明取少量厕所清洁剂放入废塑料盒中,加入紫甘蓝汁,发现溶液变为红色,得出厕所清洁剂显性;小明又取少量炉具清洁剂放入废塑料盒中,加入紫甘蓝汁,发现溶液变为色,得出厨房清洁剂显碱性;小明认为紫甘蓝汁可以替代实验室中的石蕊溶液做酸碱指示剂.
(6分)水是最普通、最常见的物质之一。
(1)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为 。
(2)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
①20℃时,NaCl的溶解度为36g。则该温度下,饱和食盐水中溶质与溶剂的质量比为 ;
②烧碱可用于处理硫酸泄漏,反应的化学方程式为 。
(3)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面上升,打开K,一段时间后导管口有气泡冒出。请分别解释导管内液面上升和下降的原因: 。
"类推"是学习化学过程中常用的思维方法.现有以下类推结果,其中错误的是()
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应;
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物;
③金属铝与盐酸反应生成
和
,所以金属铁与盐酸反应生成
和
;
④浓盐酸试剂瓶敞口久置后变稀且质量减轻,所以浓硫酸敞口久置也变稀且质量减轻.
| A. | ① | B. | ①③ | C. | ①②④ | D. | 全部 |
已知:镁在空气中燃烧生成氧化镁和氮化镁(
),氮化镁与水反应生成氢氧化镁和氨气。
(1)写出氮化镁与水反应的化学方程式 ;
(2)a 克镁在空气中完全燃烧生成固体的总质量m为;(用含a 的式子表示m 的取值范围)
(3)某学生对该混合物中氮化镁的质量分数进行测定,设计如下实验装置
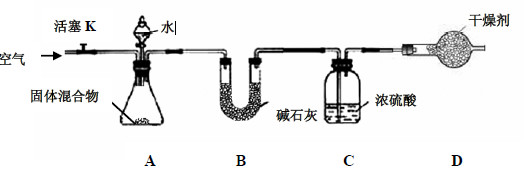
【查阅资料】
I.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与
反应。
II.
III.
是一种极易溶于水的气体。
【实验步骤】①检查装置的气密性;②精确称量镁在空气中燃烧后的固体5.00g 放入锥形
瓶中,称量装置C,连接好装置;③关闭活塞K,打开A 中分液漏斗活塞,逐滴加入水,
至样品恰好完全反应;④打开活塞K,鼓入空气;⑤再次称量装置C,装置C 增重0.34g。
请回答:
(一)装置B 的作用是;
(二)装置D 的作用是;
(三)实验步骤④中鼓入空气的目的是;
(四)固体混合物中
的质量分数为;
(五)实验证明此方法测定的结果偏低,可能原因是(写一条)
下列图像与对应选项关系合理的是
| A.在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体 |
| B.向NaOH溶液中滴加稀盐酸至过量 |
| C.用相等质量的双氧水来制取氧气 |
| D.电解水生成氢气和氧气 |
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加 , 并不断振荡. |
有 产生. |
氢氧化钠溶液一定变质了. |
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的 溶液,并不断振荡. |
有 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. |
溶液变红色. |
说明原溶液中一定有 . |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: .
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”).
某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀HNO3的白色沉淀生成。过滤,将所得滤液分成两份,一份滤液中加入少量稀H2SO4,也有不溶于稀HNO3的白色沉淀生成;另一份滤液中加入过量NaOH溶液,产生蓝色沉淀。试回答:
(1)用化学式回答:废水中加入过量的盐酸后,生成的白色沉淀是________________。
滤液中加入过量NaOH溶液后,生成的蓝色沉淀是_________________________。
(2)废水中一定含有的物质是__________________(填编号):
| A.氯化物 | B.硝酸盐 | C.硫酸盐 | D.碳酸盐 |
请简述你做出选择的理由__________________________________。
"类推"是学习化学的常用方法,下列推理正确的是()
| A. | 酸和碱生成盐和水的反应属于中和反应,故盐酸和氢氧化钠溶液能发生中和反应 |
| B. | 酸的溶液pH<7,故pH<7的溶液一定是酸的溶液 |
| C. | 镁条在空气中燃烧生成白色固体,故铜片在空气中的灼烧也生成白色固体 |
| D. | 碳可用于炼铁,故碳可用于冶炼所有的金属 |
将0.4%的氢氧化钠溶液滴加到2
0.4%的盐酸中,测得混合液的
变化曲线如图。某学习小组对加入0-
氢氧化钠过程中,所得混合液
增大原因进行了如下探究:

【猜想假设】
猜想Ⅰ:
增大是因为;
猜想Ⅱ:
增大是因为发生了反应,写出反应方程式。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:
计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2
0.4%的盐酸中加入
0.4%的氢氧化钠溶液,用pH计测得混合液的
=7。
(2)向2
0.4%的盐酸中加入
,用pH计测得混合液的
7(填">"、"="或"<")。综合(1)和(2)证明猜想Ⅱ成立。
下列四个图像分别对应四个变化过程,其中正确的是
| A.一定量的饱和石灰水中加入氧化钙 |
| B.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应 |
| C.等体积,等浓度的双氧水制取氧气 |
| D.服用胃舒平[主要成分Al(OH)3]治疗胃酸过多,胃液pH的变化 |
试题篮
()