水在生活、生产中和化学实验中起着十分重要的作用.
Ⅰ.自来水厂净化水的过程为:取水→过滤→吸附→消毒,高铁酸钾(K 2FeO 4)能用作絮凝剂.
(1)制备K 2FeO 4的化学方程式为2Fe(OH) 3+3Cl 2+10KOH═2K 2FeO 4+6X+8H 2O,则X的化学式为 ,K 2FeO 4中铁元素的化合价为 .
(2)自来水厂净化水的过程 (填"能"、"不能")将硬水软化成软水.
Ⅱ.欲证明一瓶无色透明液体是纯净水,可靠的实验方法是 .
A.1.01×10 5Pa时沸点为100℃
B.测得其pH=7
C.电解时得到H 2与O 2的体积比为2:1
Ⅲ.请根据如图实验现象并结合溶解曲度线回答(其中甲、乙、丙均不含结晶水)

(1)生石灰与水反应的化学方程式为 ,试管内所盛饱和溶液的溶质为对应溶解曲度线中的 (填甲、乙、丙).
(2)如果要配制相同浓度的甲、乙饱和溶液,需要把温度控制在 ℃.
(3)t 3℃时,将甲、乙、丙的饱和溶液都降温到t 1℃,溶液中溶质质量分数由小到大的顺序为 .
化学与生活息息相关,我们的衣、食、住、行都离不开化学。说到"行",火车、汽车、轮船、自行车等交通工具,都离不开金属材料。
(1)钢铁在潮湿的空气中会生锈,其实质是铁与空气中的 发生了缓慢氧化;采取一定的措施可防止自行车铁制部位生锈,请你列举一例 。
(2)汽车上的电瓶大多使用的是铅蓄电池,铅蓄电池报废后应回收处理,原因是 。
(3)汽车酒驾事件,当警钟长鸣。交警通过酒精检测仪可快速测出司机是否酒后驾车。其反应原理为:2X(红色)+3C 2H 5OH+3H 2SO 4=Cr 2(SO 4) 3(绿色)+3CH 3CHO+6H 2O
X的化学式为 。
有一工业过程:

按要求回答下列问题:
(1)请将电石与水反应的化学方程式补充完整:
CaC 2+2H 2O═Ca(OH) 2+ ↑.
(2)有关物质常温下的溶解度如表:
| 物质 |
Ca(ClO 3) 2 |
CaCl 2 |
KClO 3 |
KCl |
| 溶解度/g |
209.0 |
74.5 |
7.3 |
34.2 |
上述流程中加入了KCl粉末,KCl与 (填化学式)发生了复分解反应得KClO 3晶体,该过程得到KClO 3晶体的原因是 .
(3)写出向CaCl 2溶液中通入两种气体生成CaCO 3的化学方程式: .
以黄铁矿(主要成分为FeS 2)为原料生产硫酸的工艺流程如图所示:
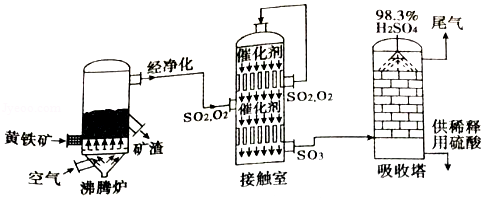
(1)沸腾炉中发生反应的化学方程式为:4FeS 2+11O 2 2X+8SO 2,其中X的化学式为 。
(2)接触室中发生反应的化学方程式为:2SO 2+O 2 2SO 3,产物SO 3中硫元素的化合价为 ;吸收塔中发生反应的化学方程式为:SO 3+H 2O═H 2SO 4,该反应的基本类型是 。若有800kg三氧化硫进入吸收塔中,且完全被吸收,则理论上制得硫酸的质量为 kg。
(3)O 2、SO 2、SO 3、H 2SO 4四种物质中属于氧化物的是 。
(4)实验室中稀释浓硫酸的操作是 。
试题篮
()