某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的元素可能是 ( )
| A.Zn 和Fe | B.Cu和C | C.Zn和Cu | D.Mg 和Al |
图象能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图象不能正确反映对应关系的是( )
A.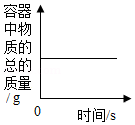 在密闭的容器中加热汞得到氧化汞
在密闭的容器中加热汞得到氧化汞
B.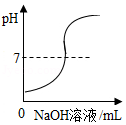 向一定量的稀盐酸中滴加氢氧化钠溶液
向一定量的稀盐酸中滴加氢氧化钠溶液
C.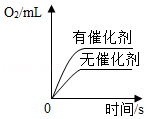 两份等质量等溶质的质量分数的过氧化氢溶液分别制取氧气
两份等质量等溶质的质量分数的过氧化氢溶液分别制取氧气
D.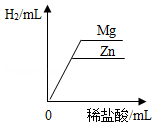 向等质量的Zn和Mg中分别滴加等溶质的质量分数的稀盐酸
向等质量的Zn和Mg中分别滴加等溶质的质量分数的稀盐酸
某研究小组欲检验草酸晶体样品分解产物并测定器质量分数(假设杂质不参与反应)。草酸晶体( H2C2O4•2H2O)的理化性质见表。
| 熔点 |
沸点 |
热稳定性 |
与澄清石灰水反应 |
| 101°C~102°C |
150°C~160°C升华 |
100.1°C失去结晶水,175°C分解成CO2,CO,H2O |
与Ca(OH)2反应产生白色沉淀(CaC2O4) |
(1)加热分解草酸晶体最适宜的装置是____________(填图1字母序号)。
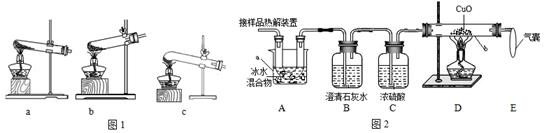
(2)图2是验证热分解产物中含CO,CO2的装置
①仪器a和b的名称分别是____________和____________。
②证明存在CO2的现象是________________________,证明存在CO的现象____________,D中反应的化学方程式是_____________。
③装置A的作用是____________________,气囊的作用是________________________。
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案。
①称一定量样品用上图装置进行实验,测得装置D反应前后的质量差,由此计算出的实验结果比实际值偏低,排除仪器和操作的因素,其原因可能有:CO未完全反应、___________________________。
②称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全。
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)则KMnO4溶液显____________色,25.00g3.16%KMnO4溶液中KMnO4的质量____________g。样品中草酸晶体的质量分数为____________。
【Mr(H2C2O4)=90,Mr(H2C2O4•2H2O)=126,Mr(KMnO4)=158】。
分析与推理是化学学习常用的方法.
(1)已知,铁与氯化铁溶液发生如下反应:Fe+2FeCl 3=3FeCl 2.如图1所示,将一段生锈的铁丝放入烧瓶中,打开K向烧瓶中加入一定量的稀盐酸后,关闭K,看到烧瓶中的固体完全消失,烧杯中导管口有气泡冒出,此时烧瓶中含铁元素的物质可能的组合是 、 (不一定填满).
(2)从含有大量硫酸铜的工业废水中提取铜,同时获得氧化铁的工业流程如图2(废水中的其他物质不参与反应,且部分产物未标出):
①操作1、操作2均为 .
②写出物质A、产品F的化学式:A ;F .
写出反应②的化学反应方程式: .
(3)已知向碳酸钠溶液中逐滴加入盐酸,随盐酸量的增加先后发生如下两个反应:
①Na 2CO 3+HCl=NaHCO 3+NaCl;②NaHCO 3+HCl=NaCl+H 2O+CO 2↑.取10.6g Na 2CO 3配成溶液,向其中逐滴加入100g溶质质量分数为3.65%的稀盐酸,理论上 (填"有"或"没有")CO 2气体产生.

在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量、等溶
质质量分数的稀硫酸,将天平调节至平衡。然后向左盘的烧杯中加入8.4g铁,反应物
之间恰好完全反应。欲使天平恢复平衡,则可向右盘的烧杯中加入
(MgCO3+H2SO4=MgSO4+CO2↑+H2O,CaO+ H2SO4= CaSO4+H2O)
| A.8.4g铝 | B.8.4g氧化钙 | C.8.4g镁 | D.8.4g碳酸镁 |
往80g含有硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,加入的镁粉的质量与溶液质量变化如图所示。试分析计算:
(1)a→b段表示镁粉与混合溶液中的 反应。(填化学式)
(2)原混合溶液中硝酸铜的质量分数是多少?(写出计算过程,精确到0.1%)

下列图像能正确反应其对应关系的是( )
A.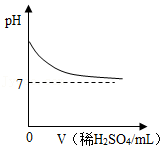 表示向一定质量的Ba(OH)2溶液中逐滴加入稀H2SO4至过量
表示向一定质量的Ba(OH)2溶液中逐滴加入稀H2SO4至过量
B.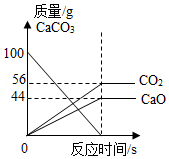 表示发生的反应为:CaCO3
表示发生的反应为:CaCO3 CaO+CO2↑
CaO+CO2↑
C. 表示等质量且过量的锌粉和铁粉,分别与质量和质量分数都相同的稀硫酸反应
表示等质量且过量的锌粉和铁粉,分别与质量和质量分数都相同的稀硫酸反应
D. 表示向盛有MnO2的烧杯中加入H2O2溶液
表示向盛有MnO2的烧杯中加入H2O2溶液
某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g;
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
一定质量M、N两种金属,分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示。分析图象得到的以下结论中,不正确的是( )

A.两种金属的活动性:M>N
B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N
D.充分反应后,得到溶液的质量:M=N
金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法: 。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤出的滤液中一定含有金属离子是 。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有铜锌合金质量20克,与100克质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。
在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系见图。综合以上信息得到以下结论,合理的是( )

A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
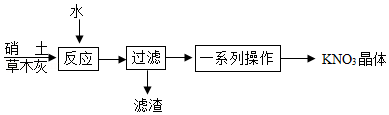
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
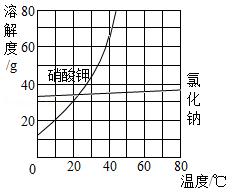
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
下面是同学们在复习中梳理得到的一组图象,其中图象与实验描述一致的是( )
A. 将氢氧化钡溶液逐滴滴入稀硫酸中至过量
将氢氧化钡溶液逐滴滴入稀硫酸中至过量
B.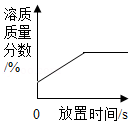 浓硫酸敞口放置一段时间
浓硫酸敞口放置一段时间
C.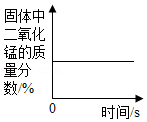 加热一定量氯酸钾和二氧化锰固体的混合物
加热一定量氯酸钾和二氧化锰固体的混合物
D. 等质量的镁、铁分别与溶质质量分数相等且足量的稀硫酸反应
等质量的镁、铁分别与溶质质量分数相等且足量的稀硫酸反应
在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图所示,读识如图并判断,下面推理合理的是( )
①反应速率:Mg>Fe>Zn
②反应生成氢气质量:Mg=Fe=Zn
③反应后溶液质量:Mg=Fe=Zn
④反应后溶液溶质质量分数:Mg<Fe<Zn。

A.①②B.③④C.①③D.②④
试题篮
()