铁缓慢氧化生成Fe2O3,发生反应的化学方程式为4Fe+ 3O2 =2Fe2O3,计算生成80g Fe2O3需要铁的质量(写出计算过程)。
(2分)现将8gA和足量的B混合加热,A和B发生化学反应,8gA完全反应后生成22gC和18gD。若现有16gB与足量的A完全反应,生成C和D的总质量为 g,
在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法不正确的是()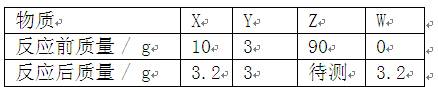
| A. | 可能是单质 |
| B. | 可能是催化剂 |
| C. | 该反应是分解反应 |
| D. | 反应后 物质的质量为86.4g |
将一定量的丙醇(
)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
| 物质 |
丙醇 |
氧气 |
水 |
二氧化碳 |
|
| 反应前质量/ | 6.0 |
12.8 |
0 |
0 |
0 |
| 反应后质量/ | 0 |
0 |
7.2 |
8.8 |
下列判断正确的是
| A. |
表中 的值为2.8 |
B. |
一定是该反应的催化剂 |
C. |
可能含有氢元素 |
D. |
若起始时氧气的质量是14.4 ,则无 生成 |
在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质质量如下表:
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量(g) |
8 |
1 |
36 |
10 |
| 反应后质量(g) |
待测 |
20 |
0 |
31 |
反应后,甲的“待测”值应为
A.10 B.8 C.4 D.0
在化学反应 中,若12 与一定量的 恰好完全反应,生成28 和2 ,则参加反应的 的质量为
| A. | 8 | B. | 18 | C. | 28 | D. | 30 |
在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。关于此反应下列认识不正确的是( )
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量/ | 1 |
20 |
15 |
2 |
| 反应后质量/ | 29 |
0 |
8 |
| A. |
的值是1 |
B. |
甲可能是该反应的催化剂 |
| C. |
该反应是分解反应 |
D. |
反应中乙、丁的质量比是29:8 |
一定条件下,一定量的化合物
和 恰好完全反应,生成
和
,则
物质的相对分子质量不可能是
恰好完全反应,生成
和
,则
物质的相对分子质量不可能是
| A. | 26 | B. | 40 | C. | 58 | D. | 90 |
硅酸钠(Na2SiO3)是我国优先发展的精细化工产品,工业制备的反应为:
2NaOH+ SiO2 ="=" Na2SiO3 + H2O 。现以125t石英砂(SiO2质量分数为96%)为原料,与
足量的NaOH溶液反应。试计算:
(1)125t石英砂中SiO2的质量。
(2)理论上得到硅酸钠的质量。
为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.76g。计算贝壳中碳酸钙的质量分数。
已知碳酸氢钠与氢氧化钠固体在加热条件下,发生如下反应:
NaHCO3+NaOH△Na2CO3+H2O现将4.2g NaHCO3固体与足量NaOH固体混合,加热使其充分反应。请问反应后能生成多少克Na2CO3固体? (相对原子质量:H—1 C—12 O—16 Na—23)
某工厂排放的废水中含有氯化氢( ),现取废水 ,向其中加入 质数分数为 的氢氧化钠溶液恰好完全反应( )。计算: 废水中氯化氢的质量。(相对原子质量: )
(6分)实验室有一瓶氯化钠和碳酸钠的混合物,某同学为了确定它的组成做了如下实验:首先取l 6 g混合物放入烧杯中,然后向烧杯中滴加稀盐酸,直到不再产生气泡为止,共加入稀盐酸159.4 g,测得反应后剩余物质的总质量为171 g。求:
(1)此瓶混合物中所含碳酸钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体试样中Ca(OH)2的质量分数为
| A.30% | B.40% | C.50% | D.60% |
某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
| 反应时间/min |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
| 剩余固体质量/g |
2.55 |
2.25 |
2.10 |
2.04 |
M |
2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为_______________g;
(2)根据表中数据分析M的值是 _g
(3)原混合物中氯酸钾的质量分数是多少?(请写出计算过程)
试题篮
()