在反应3X+4Y=2Z中,已知X的相对分子质量是32,Z的相对分子质量是102,则Y的相对分子质量为
| A.27 | B.70 | C.108 | D.1 72 |
取一定量氧化钙和氢氧化钙组成的混合物加入到800g水中使其完全溶解,再向该溶液中通入适量的二氧化碳气体,至固体质量恰好不再增加,过滤,得滤液800.18g,干燥后得2g滤渣,则原混合物中氢氧化钙的质量是
| A.0.56g | B.1.12g | C.0.74g | D.1.48g |
工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是: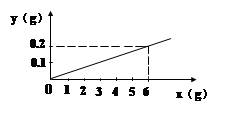
| A.纯净的锌 |
| B.含铜的锌 |
| C.含有不与酸反应的杂质的锌 |
| D.含有不与酸反应的杂质的铁 |
烧杯中盛有溶质质量分数一定的NaCl溶液,溶液全部倒出后,用蒸馏水洗涤2次,每次用20 mL蒸馏水,若烧杯内每次残留0.5 mL溶液,经2次洗涤后烧杯内残留的NaCl溶液中溶质的质量分数约为原NaCl溶液的(NaCl溶液的密度均按1 g/cm3计算)
| A.1/81 | B.1/400 | C.1/820 | D.1/1681 |
、 的混合粉末3.20g,,高温下与足量 充分反应后,得到固体的质量可能为()
| A. |
2.24g |
B. |
2.40g |
C. |
2.56g |
D. |
4.00g |
在反应A+3B=2C+2D中,当7gA与一定量B充分反应后,生成了22gC和9gD,则B与D的相对分子质量之比为
| A.8∶3 | B.16∶9 | C.3∶2 | D.1∶1 |
铝在氧气中燃烧生成氧化铝。在这个反应中,铝、氧气、氧化铝的质量比是( )
| A.27: 24:51 | B.27:16:43 | C.4:3:2 | D.27:32:59 |
在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前的质量(g) |
20 |
50 |
80 |
30 |
| 反应后的质量(g) |
0 |
100 |
10 |
x |
请根据质量守恒定律判断x的值
A.50
B.40
C.10
D.70
在反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7:8,当2.8gA与一定量B恰好完全反应后,生成3.6gD,则C的质量为
| A.6.8g | B.9.6g | C.8.8g | D.4.4g |
在 和 的混合气体中,碳元素的质量分数是36%,将该气体10 g通过足量灼热的 粉末,完全反应后,气体通入足量的澄清石灰水中,得到白色沉淀的质量是( )
| A. | 10 g | B. | 13.4 g | C. | 30 g | D. | 40 g |
碳酸氢钠用于焙制糕点,在270℃时分解: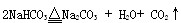 。现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为()。
。现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为()。
| A.4.4g | B.6.2g | C.8.8g | D.10.6g |
碳酸钙在高温条件下发生如下反应:CaCO3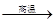 CaO+CO2↑。将100 g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑。将100 g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
| A.28.0 g | B.44.8 g | C.56.0 g | D.78.0 g |
试题篮
()